Dr. Martin Dib M.
Dr. Sergio Riveros G.
El trasplante hepático es la mejor alternativa terapéutica para pacientes con insuficiencia hepática terminal, insuficiencia hepática fulminante y algunos candidatos oncológicos con buena biología tumoral. La gran limitante, tanto en Chile como en el mundo, es la escasez de órganos para una demanda de pacientes que crece exponencialmente. En Chile, el problema es aún más acentuado porque presenta una de las tasas de donación más bajas del mundo, en 2018 fue de 6,7 por millón de habitantes frente al líder mundial en políticas de donación, España, con 48,9 por millón de habitantes, sumado a una alta tasa de negativa familiares, lo que determina una mortalidad en lista de espera de alrededor del 35 - 40%.
Existen múltiples estrategias para hacer frente a este problema, tales como cambios en políticas públicas, trasplante hepático con donante vivo, injertos provenientes de muerte cardiaca y la utilización de injertos marginales (edad avanzada, injertos grasos o prolongados tiempos de isquemia). Las tres primeras estrategias son de difícil implementación y requieren tiempo para obtener buenos resultados. Sin embargo, se estima que un 20 - 40% de los injertos marginales se descartan para trasplante por presentar criterios de marginalidad, como esteatosis hepática. Se calcula que, en Chile, se descartan alrededor de 80 injertos al año, lo que corresponde a casi la mitad de pacientes enlistados a nivel nacional. De esta forma, debemos buscar estrategias que permitan rescatarlos y utilizarlos de forma segura en trasplante.
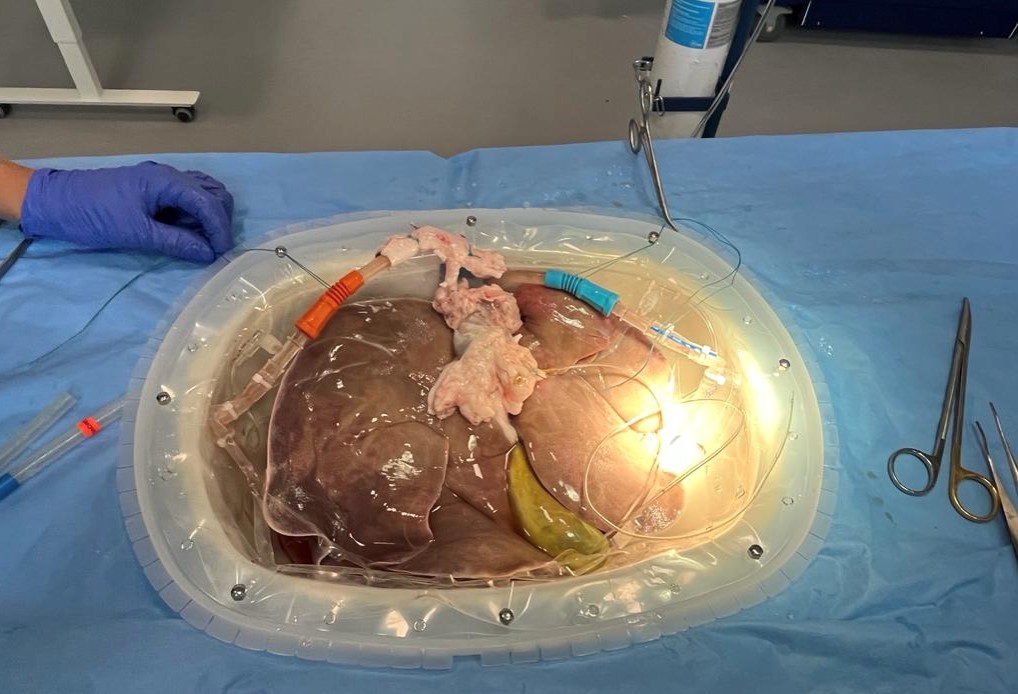
La perfusión ex-vivo es una técnica de preservación del injerto que modifica el efecto perjudicial del almacenamiento en frío, técnica estándar actual de preservación, al mantener los órganos en una condición más fisiológica. La perfusión ex-vivo suministra oxígeno y nutrientes, con un control de temperatura. Dos grandes líneas de trabajo se han desarrollado en esta materia, la perfusión hipotérmica oxigenada (HOPE) y la perfusión normotérmica (NMP). Ambas permiten aumentar el tiempo de preservación total de una manera segura para el injerto, disminuir el estrés oxidativo generado por el metabolismo anaeróbico y mantener el metabolismo mitocondrial disminuyendo la apoptosis celular. Estos beneficios son mayores en aquellos injertos marginales, debido a que cuentan con una menor capacidad de mecanismos compensatorios.
Una de las ventajas adicionales de la perfusión normotérmica (37C) es la capacidad de evaluar la viabilidad del injerto durante la preservación ex-vivo. En estudios recientes, hígados descartados para trasplante, por ser injertos marginales preservados ex- vivo, demostraron viabilidad mediante distintos criterios, tales como; aclaramiento de lactato, producción de bilis, corrección de pH, y perfusión adecuada. Alrededor de un 70% cumplieron estos criterios de viabilidad y fueron trasplantados exitosamente, con una sobrevida del paciente y del injerto de un 100% a 90 días. Estas estrategias permiten rescatar un número considerable de injertos que en condiciones estándar serían rechazados para trasplante.
El impacto de estas nuevas estrategias de preservación radica en la maximización en la utilización de injertos marginales, lo que aumentó considerablemente el número de órganos disponibles para trasplante, disminuyendo significativamente la mortalidad en lista de espera de nuestros pacientes. Esto es aplicable, no solamente para el hígado, sino también para otros órganos, tales como el pulmón o el riñón. Avanzar con estas nuevas tecnologías en preservación permitirán, en un futuro, intervenir farmacológicamente los injertos, la reparación celular, potenciar la regeneración, la modulación de respuesta inflamatoria e inmunológica, la terapia génica, entre muchas otras alternativas. Por nuestros pacientes debemos incorporar estas estrategias a nuestra práctica clínica diaria.
Referencias
- Trotter JF. Liver transplantation around the world. Curr Opin Organ Tran. 2017;22(2):123–7.
- Guerra JF, Quezada JL, Cancino A, Arrese M, Wolff R, Benítez C, et al. Trasplante hepático: evolución, curva de aprendizaje y resultados después de los primeros 300 casos. Revista Médica De Chile. 2019;147(8):955–64.
- Kim WR, Lake JR, Smith JM, Schladt DP, Skeans MA, Harper AM, et al. OPTN/SRTR 2016 Annual Data Report: Liver. Am J Transplant. 2018;18(S1):172–253.
- Uribe M, González G, Paravic N. Transplante Hepático en Chile: Pasado, Presente y Futuro. Revista De Cirugía. 2020;72(5).
- Cohens FG, Cid FV, Droguett RA, Fuenzalida FG. Análisis crítico de la baja tasa de donación de órganos en Chile. Revista Médica De Chile. 2020;148(2):242–51.
- Saidi RF. Utilization of expanded criteria donors in liver transplantation. Int J Organ Transplant Medicine. 2013;4(2):46–59.
- Graham JA, Guarrera JV. “Resuscitation” of marginal liver allografts for transplantation with machine perfusion technology. J Hepatol. 2014;61(2):418–31.
- Michelotto J, Gassner JMGV, Moosburner S, Muth V, Patel MS, Selzner M, et al. Ex vivo machine perfusion: current applications and future directions in liver transplantation. Langenbeck’s Archives Surg. 2021;406(1):39–54.
- Burra P, Zanetto A, Russo F, Germani G. Organ Preservation in Liver Transplantation. Semin Liver Dis. 2018;38(03):260–9.
- Tchilikidi KY. Liver graft preservation methods during cold ischemia phase and normothermic machine perfusion. World J Gastrointest Surg. 2019;11(3):126–42.
- Vries Y de, Berendsen TA, Fujiyoshi M, Berg AP van den, Blokzijl H, Boer MT de, et al. Transplantation of high-risk donor livers after resuscitation and viability assessment using a combined protocol of oxygenated hypothermic, rewarming and normothermic machine perfusion: study protocol for a prospective, single-arm study (DHOPE-COR-NMP trial). Bmj Open. 2019;9(8):e028596.
- Balfoussia D, Yerrakalva D, Hamaoui K, Papalois V. Advances in Machine Perfusion Graft Viability Assessment in Kidney, Liver, Pancreas, Lung, and Heart Transplant. Exp Clin Transplant. 2012;10(2):87–100.
- Mergental H, Laing RW, Kirkham AJ, Perera MTPR, Boteon YL, Attard J, et al. Transplantation of discarded livers following viability testing with normothermic machine perfusion. Nat Commun. 2020;11(1):2939.
- Gasperi AD, Mazza E, Prosperi M. Indocyanine green kinetics to assess liver function: Ready for a clinical dynamic assessment in major liver surgery? World J Hepatology. 2016;8(7):355–67.