Vasopresina en shock séptico: De la fisiología a la evidencia clínica
- Trabajo de Revisión
- 193 vistas
Resumen
Resumen: El shock séptico (SS) es un motivo frecuente de ingreso a Unidades de Cuidados Intensivos y una de sus principales causas de muerte. Los pacientes con SS que requieren dosis altas de catecolaminas exógenas por períodos prolongados presentan una elevada mortalidad. La arginina vasopresina (VP) es una hormona liberada principalmente en respuesta a cambios en la osmolaridad plasmática, regulando la reabsorción de agua a nivel renal; sin embargo, en estados de shock circulatorio juega un rol fundamental como vasoconstrictor para restaurar la presión de perfusión. En pacientes con SS se ha documentado un comportamiento bifásico en la liberación de VP, detectándose concentraciones elevadas en la fase inicial y un descenso progresivo cuando la condición se prolonga en el tiempo, alteración conocida como deficiencia relativa de VP. En la presente revisión narrativa de la literatura actualizaremos el sustento fisiológico y la evidencia científica sobre el empleo de VP en SS.
Abstract
Septic shock (SS) is a frequent reason for admission to Intensive Care Units and one of its leading causes of death. Patients with SS who require high doses of exogenous catecholamines for prolonged periods have high mortality. Arginine vasopressin (VP) is a hormone released mainly in response to changes in plasma osmolarity, regulating water reabsorption in the kidney. VP plays a fundamental role in circulatory shock as a vasoconstrictor to restore perfusion pressure. A biphasic behavior in VP release has been documented in patients with SS. In the initial phase, high concentrations of VP can be detected with a progressive decrease if SS continues, an alteration known as relative VP deficiency. In this narrative review of the literature, we will update the physiological support and the scientific evidence on the use of VP in SS.
Keywords: Critically ill patients; Refractory shock; Septic shock; Vasoplegia; Vasopressin.
Introduccion
La sepsis y el shock séptico son entidades que cobran la vida de miles de personas alrededor del mundo cada día1,2,3. Un aspecto trascendente sobre la implementación de iniciativas internacionales de educación y capacitación (como Surviving Sepsis Campaign y Global Sepsis Alliance), es que han conseguido visibilizar y difundir que la sepsis es una entidad tiempo-dependiente, y que su rápida identificación es imperativa para reducir los malos desenlaces4,5,6. Por otra parte, un reconocimiento tardío y la progresión a shock séptico incrementan ostensiblemente el riesgo de muerte7. Los factores implicados en la hipotensión del shock séptico son multifactoriales e incluyen vasoplejía, hipovolemia relativa, depleción de volumen intravascular y depresión miocárdica8. La excesiva vasodilatación en el shock séptico ocurre pese a la existencia de elevadas concentraciones de catecolaminas endógenas y de la activación del sistema renina-angiotensina-aldosterona. Entre los mecanismos involucrados en la vasoplejía se encuentran: una excesiva producción de óxido nítrico por la óxido nítrico sintetasa inducible (ONi), la activación de canales de potasio sensibles a ATP, la acción del factor hiperpolarizante derivado del endotelio, desensibilización de los receptores de vasopresores, y las bajas concentraciones circulantes de vasopresina (VP)9,10. El enfrentamiento precoz y protocolizado del shock séptico puede evitar la progresión de hipotensión a hipoperfusión tisular y disfunción orgánica, lo que potencialmente se traduciría en una mejora significativa en las posibilidades de sobrevida de los pacientes11.
El efecto vasopresor del extracto de hipófisis se describió por primera vez en 1895 y fue atribuido al lóbulo posterior de esta glándula. En tanto que su acción antidiurética se identificó después de casi 20 años, y no fue sino hasta la década de los 50’ que se pudo demostrar que la misma hormona poseía ambos efectos12. Las concentraciones plasmáticas de VP normalmente son inferiores a 4 pg/mL en individuos sanos con una hidratación adecuada; en tanto que, en estados de shock se produce un incremento de sus concentraciones de 20 a 200 veces13. Estas concentraciones suprafisiológicas generan una vasoconstricción intensa cuya finalidad es preservar la perfusión de los órganos. Sin embargo, si el shock es prolongado, se produce una disminución progresiva de las concentraciones plasmáticas12,14. Paradójicamente, la VP puede ocasionar simultáneamente vasodilatación en algunos territorios vasculares, lo que la diferencia de otros agentes vasopresores15,16,17.
Una pequeña proporción de pacientes pueden desarrollar un shock séptico refractario a las medidas convencionales de reanimación, pese a un adecuado abordaje inicial, lo que implica el requerimiento de dosis altas de vasopresores para alcanzar la meta de presión arterial media (PAM)8. En este contexto, el empleo de dosis altas de catecolaminas exógenas se ha asociado a una elevada mortalidad (? 60%)18,19,20. Una alternativa de soporte vasoactivo con un mecanismo de acción diferente (no catecolamínico) podría tener un efecto sinérgico y generar un impacto positivo en este subgrupo de pacientes. En la presente revisión narrativa de la literatura actualizaremos el sustento fisiológico y la evidencia científica sobre el empleo de VP en shock séptico.
Efectos fisiológicos
La arginina vasopresina u hormona antidiurética, neuropéptido de 9 aminoácidos, es sintetizada por las neuronas magnocelulares del hipotálamo y almacenada en la hipófisis posterior, desde donde es liberada al organismo ante estímulos osmóticos (hiperosmolaridad) y no osmóticos (hipovolemia/hipotensión) (Figura 1). La VP tiene una semivida de eliminación corta (5-15 min), debido a que es rápidamente metabolizada por las vasopresinasas hepática y renal12,21. En condiciones fisiológicas, la VP no interviene mayormente en la regulación de la presión arterial; sin embargo, en situaciones de hipotensión profunda y sostenida, juega un rol protagónico para mantener la presión de perfusión tisular.
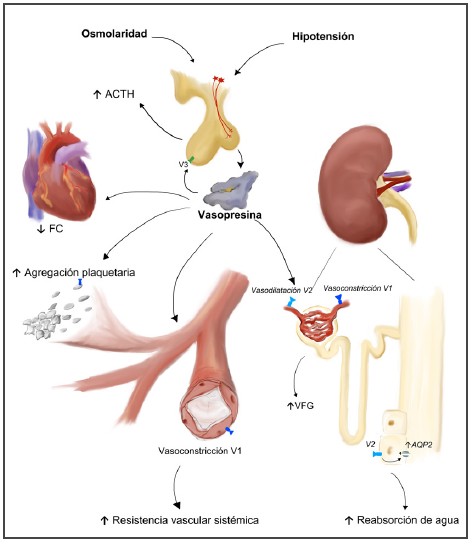
Figura 1: Mecanismos de acción de vasopresina
sobre los receptores V1, V2 y V3 en shock.
*En dosis altas vasopresina puede ocasionar vasoconstricción
excesiva con riesgo de isquemia tisular.
Ilustración cortesía del Dr. Diego Ugalde Castillo. Unidad de
Pacientes Críticos. Hospital Clínico Universidad de Chile
La VP ejerce sus efectos fisiológicos a través de 4 subtipos de receptores específicos13: V1 (anteriormente denominados V1a), V2, V3 (anteriormente denominados V1b) y receptores de oxitocina (ROT) (Tabla 1). Su acción vasoconstrictora se lleva a cabo por estimulación de los receptores V1 localizados en el músculo liso vascular, inhibiendo la producción de GMP cíclico mediada por óxido nítrico, y por bloqueo de los canales de potasio sensibles a ATP9,13. Su efecto antidiurético es producto de la acción sobre receptores V2 localizados en las células principales de los túbulos colectores renales12. Por otra parte, a través de un mecanismo dependiente de la dosis, es capaz de inducir un incremento de la perfusión renal y del débito urinario por vasoconstricción selectiva de las arteriolas glomerulares eferentes al actuar sobre receptores V1 y/o por vasodilatación de las arteriolas glomerulares aferentes a través de receptores V222,23,24. Además, es capaz de reducir la activación del sistema renina-angiotensina-aldosterona25,26. Por otra parte, se ha reportado que la administración de VP puede ejercer un efecto antiinflamatorio pulmonar mediado por recetores V2 y también a nivel sistémico27,28, lo que estaría en concordancia con evidencia actual que respalda la existencia de receptores V2 a nivel vascular extra renal y en otros tejidos29. En bajas dosis VP puede inducir vasodilatación coronaria, cerebral, renal y pulmonar12,30.
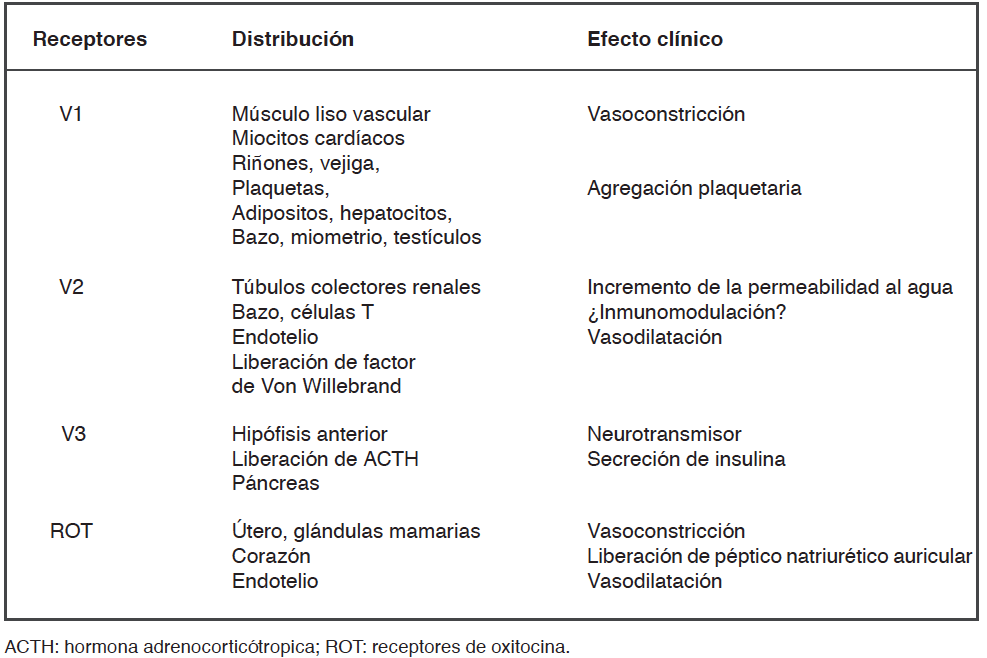
La acción de VP sobre los receptores hipofisarios V3 incrementa la producción y liberación de hormona adrenocorticotrópica (ACTH), la cual estimula la liberación de cortisol. La VP también estimula los ROT que se encuentran en el útero, glándulas mamarias, corazón y células endoteliales13. La estimulación de los ROT puede generar una respuesta vasodilatadora, a través de la activación de la vía del óxido nítrico en las células endoteliales12. Llamativamente, a diferencia de la desensibilización observada con catecolaminas exógenas, durante el shock séptico la sensibilidad a la acción de VP se encuentra incrementada y además puede potenciar el efecto de otros agentes vasoconstrictores31.
En los últimos años ha resurgido el interés por la incorporación de VP al manejo hemodinámico de pacientes con shock séptico. Esta renovada tendencia está asociada al conocimiento actual de una deficiencia relativa de esta hormona en algunos pacientes con shock séptico establecido. Landry et al.32, observaron que los pacientes con shock cardiogénico mostraban concentraciones de VP de 22,7±2,2 pg/mL, mientras que pacientes con shock séptico del mismo nivel de gravedad presentaron concentraciones plasmáticas de 3,1±1,0 pg/mL (p <0,001). Este fenómeno de deficiencia relativa estaría explicado por: a) una depleción neurohipofisaria de VP secundaria a liberación excesiva de la misma en los estadios iniciales del shock séptico (únicamente 10% a 20% de la hormona almacenada puede ser liberada rápidamente), b) elevadas concentraciones circulantes de norepinefrina (NE) y de glucocorticoides endógenos, c) estimulación disminuida de la liberación de VP por disfunción autonómica o inhibición tónica de los receptores de volumen auriculares, y d) liberación masiva de óxido nítrico12,33,34,35. Sharshar et al.36, encontraron en su serie que cerca de un tercio de los pacientes con shock séptico tardío presentó una deficiencia relativa de VP (?3,6 pg/ml en presencia de hipernatremia o una presión arterial sistólica <100 mmHg).
La deficiencia relativa de VP puede perpetuar la inestabilidad cardiovascular, con el consiguiente requerimiento de dosis altas de vasopresores. La infusión de dosis bajas de VP ha demostrado incrementar su concentración plasmática en rangos entre 30 y 130 pg/mL, generando un aumento de la resistencia vascular sistémica (RVS) y de la PAM, con escasos efectos adversos22,32,37.
Estudios clínicos
Ensayos experimentales y en humanos han demostrado la seguridad y potenciales beneficios del empleo de VP en dosis bajas22,37,38,39. En una pequeña serie prospectiva observacional chilena, que incluyó pacientes con shock séptico sin depresión miocárdica (Requerimiento de NE ?0,3 µg/kg/min e índice cardíaco ?3 L/min/m2), los autores reportaron una reducción significativa de las dosis de NE (0,8±0,5 vs 0,45±0,4 µg/kg/min; p <0,01) y un incremento de la RVS (884±337 vs 1206±235 dina/seg/cm-5; p <0,05), con la suplementación de 0,02 U/min de VP por 24 horas. Durante el período de estudio no se observó deterioro del índice cardíaco, ni tampoco incremento de la diferencia entre la PCO2 gástrica y arterial (PCO2 gap) en la tonometría40. Dubois et al.41, observaron que la infusión de VP en una dosis de 0,02 U/min no comprometió la microcirculación sublingual evaluada con videomicroscopía (OPS, Orthogonal Polarization Spectral). Por el contrario, cuando se ha empleado VP como vasopresor primario ajustando la dosis (0,06 a 1,8 U/min) para meta de PAM, se ha documentado una reducción del índice cardíaco (3,8±1,3 a 3,0±1,1 L/min/m2; p <0,05) e incremento del PCO2 gap (17,5±26,6 a 36,5±26,6 mmHg; p <0,01)42. Adicionalmente, el empleo de VP en dosis altas (> 0,04 U/min) se ha asociado a alteración de la perfusión esplácnica, lesiones cutáneas isquémicas, elevación de enzimas hepáticas, y de concentraciones plasmáticas de bilirrubina, lo que podría indicar un deterioro de la función hepática43,44,45,46,47,48. Asimismo, se ha documentado el desarrollo de trombocitopenia posiblemente mediada por receptores V147.
El estudio VASST (Vasopressin and Septic Shock Trial), fue un ensayo clínico multicéntrico, doble ciego, aleatorizado, que incluyó 778 pacientes con shock séptico recibiendo una dosis de NE ?5 µg/min. Los pacientes fueron asignados a una infusión de VP (0,01 a 0,03 U/min) o NE (5 a 15 µg/min). El desenlace primario del estudio fue mortalidad a 28 días. Los autores no pudieron demostrar una reducción en la mortalidad con el empleo de VP, a pesar de que su administración se asoció a una reducción significativa en las dosis de NE (p <0,001). El análisis de un subgrupo definido a priori de pacientes menos graves (requerimiento de NE 5 a 14 µg/min al momento de la aleatorización), documentó que el grupo tratado con la combinación NE/VP, experimentó una reducción significativa de la mortalidad a 90 días en comparación al grupo que recibió solamente NE (35,8% vs 46,1%; p = 0,04). No obstante, este hallazgo debe ser tomado con precaución, ya que la hipótesis del estudio sostenía que la intervención tendría mayor probabilidad de beneficiar a los pacientes más graves37.
Por otra parte, la administración concomitante de VP y corticoides podría resultar en una interacción farmacodinámica y farmacocinética potencialmente beneficiosa. La VP activa el eje hipotálamo-hipófisis-suprarrenal al unirse a los receptores V3 ubicados en la hipófisis anterior, lo que estimula la liberación de ACTH y finalmente, da como resultado un aumento en la concentración plasmática de cortisol. Además, el cortisol exógeno puede aumentar potencialmente la concentración de VP al aumentar la regulación del sistema vasopresinérgico hipotalámico o al reducir la eliminación de VP. Los corticoides también podrían mejorar la respuesta a la VP y aumentar los efectos antiinflamatorios de la combinación VP/corticoides49.
Un análisis post hoc del estudio VASST50, encontró una importante interacción entre la administración de corticoides y VP. Así, el subgrupo de enfermos que recibió la combinación de VP/corticoides tuvo menor mortalidad (35,9% vs 44,7%; p = 0,03) y disfunción de órganos a los 28 días (p = 0,02) que el subgrupo de pacientes que recibió la combinación NE/corticoides. Sin embargo, es necesario considerar que se trata del análisis de un subgrupo no definido a priori y que la administración de corticoides fue permitida en cualquier momento dentro de los 28 días post aleatorización.
En relación con este tópico, más recientemente, un estudio abierto, aleatorizado y controlado con placebo evaluó el efecto de la administración de 50 mg de hidrocortisona intravenosa cada 6 horas o placebo sobre la concentración plasmática de VP en pacientes asignados a una infusión de VP de 0,01 a 0,06 U/min para PAM de 65-75 mmHg. En comparación con placebo, la adición de hidrocortisona disminuyó la duración del tratamiento con VP en 3 días (p = 0,001) y la dosis de VP administrada a la mitad (0,04 U/min a 0,02 U/min; p = 0,001)51. Cabe destacar que la administración de hidrocortisona no aumentó las concentraciones plasmáticas de VP, por lo éste no pareciera ser su mecanismo de acción.
El VANISH (Vasopressin vs Norepinephrine as Initial Therapy in Septic Shock) fue un estudio clínico multicéntrico, doble ciego, aleatorizado, de diseño factorial 2x2 (VP + hidrocortisona o placebo vs. NE + hidrocortisona o placebo), que incluyó 409 pacientes y cuyo objetivo primario fue establecer si el uso de VP como vasopresor inicial (titulada hasta 0,06 U/min), podría mejorar el desenlace renal a 28 días comparada con NE (titulada hasta 12 µg/min)52. Si la meta de PAM (65-75 mmHg) no era alcanzada con las dosis previamente establecidas para ambos agentes, se iniciaba una infusión abierta de NE. No se encontró diferencia significativa en el porcentaje de sobrevivientes que nunca desarrollaron falla renal (57% VP vs 59,2% NE; 95% IC -13,0% a 8,5%). La proporción de uso de terapia de reemplazo renal fue significativamente menor en el grupo VP (25,4%) comparada con el grupo NE (35,3%) (OR 0,40; 95% IC 0,20-0,73), hallazgo que podría ser concordante con lo reportado por el análisis post hoc del VASST53. No obstante, esta diferencia en el uso de terapia de reemplazo renal en el estudio VANISH fue más pronunciada en el subgrupo de pacientes que no sobrevivieron (38,1% VP vs 69,6% NE) en comparación a los que sobrevivieron (19,9% VP vs 22,3% NE). No existió diferencia entre los grupos en la mortalidad a 28 días (30,9% VP vs 27,5% NE; 95% IC?5,4% a 12,3%), así como tampoco en cuanto al total de eventos adversos graves (10,7% VP vs 8,3% NE). Sin embargo, el empleo de VP como vasopresor inicial en dosis de hasta 0,06 U/min, se asoció a una mayor incidencia de isquemia digital (5,4% VP vs 1,5% NE).
Un elemento común a todos los estudios clínicos aleatorizados llevados a cabo en la población general de pacientes con shock séptico, ha sido que la infusión de VP consistentemente ha llevado a una reducción en la dosis de NE, lo que podría ser un efecto clínico beneficioso, ya que dosis altas de catecolaminas exógenas pueden producir un efecto cronotrópico excesivo (con el consiguiente riesgo de taquiarritmias), alteración de la función diastólica, isquemia miocárdica, inmunosupresión, edema pulmonar, hipercoagulabilidad e isquemia intestinal54,55,56. En el estudio prospectivo, multicéntrico, aleatorizado SEPSISPAM (Sepsis and Mean Arterial Pressure), el empleo de dosis más altas de NE en el grupo asignado a una meta de PAM de 80 a 85 mmHg, se asoció a una mayor incidencia de fibrilación auricular57. Un metaanálisis de 23 estudios clínicos aleatorizados incorporando 3.088 pacientes con shock distributivo, evaluó la incidencia de fibrilación auricular con el uso combinado de VP más una catecolamina vasopresora (mayoritariamente NE) en comparación con el empleo exclusivo de una catecolamina. Los investigadores encontraron que la adición de VP a una catecolamina estuvo asociada a un menor riesgo fibrilación auricular (RR 0,77; 95% IC 0,67 a 0,88)58.
Hajjar et al.59, encontraron que la administración de VP comparada con NE, en pacientes con shock vasopléjico post cardiocirugía, redujo la incidencia de complicaciones quirúrgicas graves y la mortalidad a 30 días. En base a estos resultados alentadores los investigadores planificaron un estudio dirigido a una población más específica de pacientes críticos. El VANCS II (Vasopressin versus Norepinephrine for the Management of Septic Shock in Cancer Patients) fue un estudio prospectivo, doble ciego, aleatorizado, llevado a cabo en un solo hospital de Brasil60. La hipótesis de los investigadores fue que el uso de VP como vasopresor de primera línea (0,01 a 0,06 U/min), comparada con NE (10 a 60 µg/min), podría reducir la mortalidad a 28 días en pacientes con cáncer que desarrollaran un shock séptico. Si la meta de PAM (?65 mmHg) no era alcanzada, se iniciaba una infusión abierta de NE. Se incluyeron 250 pacientes, 125 asignados a recibir VP y 125 a NE. El estudio no pudo demostrar una diferencia significativa entre los grupos en el objetivo primario (56,8% VP vs 52,8% NE; p = 0,52). Tampoco se pudo documentar diferencias significativas en la mortalidad a 90 días (72% VP vs. 75,2% NE; p = 0,56), ni en el número de días con vida sin soporte vital avanzado (p = 0,74). En términos de seguridad, no se reportaron diferencias entre los grupos en la incidencia de eventos adversos graves (47,2% VP vs 46,4% NE; p = 0,42).
Un metaanálisis que incluyó 11 estudios clínicos con 2.691 pacientes con shock distributivo tuvo como objetivo primario evaluar el impacto de la administración de VP (y su análogo sintético terlipresina) sobre la función renal. En comparación a otros vasopresores, los pacientes en el grupo intervención tuvieron una menor incidencia de lesión renal aguda y necesidad de terapia de reemplazo renal (OR 0,59 95% IC 0,37–0,92; p = 0,02); sin embargo, esta reducción no alcanzó significancia estadística en el subgrupo de pacientes con shock séptico (OR 0,75; 95% IC 0,54-1,04; p = 0,08)61.
Adicionalmente, un metaanálisis de los datos de pacientes individuales de 4 estudios clínicos aleatorizados (1.453 pacientes), cuyo objetivo primario fue evaluar el impacto de la administración de VP sobre la mortalidad a 28 días en pacientes con shock séptico62, no encontró diferencia significativa entre los grupos (RR 0,98; 95% IC 0,86-1,12). Tampoco la hubo en la incidencia de eventos adversos graves (RR 1,02; 95% IC 0,82-1,26), aunque documentó un menor requerimiento de terapia de reemplazo renal en los pacientes que recibieron VP (RR 0,86; 95% IC 0,74-0,99). Otro grupo de investigadores ha corroborado recientemente este último resultado (OR = 0,63; 95% IC 0,44 a 0,88; p = 0,007)63. En la misma línea, Jiang et al.64 en un metaanálisis de 20 estudios clínicos sobre el uso de VP y sus análogos (terlipresina y selepresina), encontraron una reducción de mortalidad en pacientes con shock séptico (RR 0,92; 95% IC 0,84 a 0,99; p = 0,03).
Dada la ausencia de resultados positivos en términos de reducción de mortalidad en los estudios aleatorizados de pacientes con shock séptico, algunos autores han evaluado la cuantificación de las concentraciones plasmáticas de Copeptina (Fracción terminal de la molécula de provasopresina), que es más estable y menos compleja de medir que VP, como herramienta para identificar a los enfermos críticos que se pudieran beneficiar de la adición de VP; lamentablemente, todavía no se ha podido establecer su verdadera utilidad clínica65,66.
En atención a la evidencia existente, la versión más reciente de la Surviving Sepsis Campaign sugiere adicionar VP en lugar de seguir incrementando las dosis de NE en pacientes con shock séptico, y proponen un rango de dosis de NE entre 0,25 y 0,5 µg/kg/min para su inicio (Recomendación débil, moderada calidad de la evidencia)5. Hasta el momento, los estudios clínicos más recientes involucrando otros análogos sintéticos de VP, tales como terlipresina y selepresina, han generado resultados desalentadores en pacientes con shock séptico5,67,68,69.
Otras consideraciones prácticas
Aspectos menos explorados sobre el uso de VP en shock séptico han sido la dosis umbral de vasopresor primario para adicionar VP, el momento de inicio y la estrategia de suspensión. Wu et al.70, llevaron a cabo un estudio retrospectivo pre y post intervención luego de la modificación de su protocolo institucional para el inicio de VP en pacientes con shock séptico. Con este propósito compararon dos períodos con distintos umbrales para la adición de VP (10 µg/min vs 50 µg/min de NE). Los investigadores encontraron que restringir el inicio de VP a pacientes con una dosis de NE de 50 µg/min, no prolongó el tiempo para alcanzar la meta de PAM (?65 mmHg), ni incrementó la mortalidad. No obstante, los grupos no estuvieron balanceados en términos de gravedad (APACHE II 23 preintervención vs. 18 postintervención; p < 0,001) y la dosis mediana de NE en la que se adicionó VP en el grupo preintervención fue 18 µg/min (el equivalente a 0,26 µg/kg/min para una persona de 70 Kg). Un estudio retrospectivo realizado en Brasil evaluó la evolución a corto plazo de 80 pacientes con shock séptico en quienes se adicionó VP después de ser refractarios a una dosis de 1 µg/kg/min de NE. La mortalidad a 30 días en este subgrupo de pacientes fue de 86% y 75% murieron en las primeras 72 horas71.
Por otra parte, un estudio prospectivo abierto tuvo como objetivo primario evaluar el efecto del inicio temprano de VP (dentro de 4 horas de iniciada NE) sobre el tiempo transcurrido para alcanzar una PAM ?65 mmHg. El inicio temprano de VP redujo el tiempo para alcanzar y mantener la meta de PAM72.
De manera similar, aún no está claro qué vasopresor debería suspenderse primero cuando se emplean NE y VP en forma simultánea. Un estudio prospectivo, doble ciego aleatorizado73, cuyo objetivo primario fue evaluar la incidencia de hipotensión asociada a la reducción de vasopresores, encontró una mayor incidencia de hipotensión con el retiro primario de NE en comparación a VP (68,4% vs 22,5%; p <0,001). No obstante, un metaanálisis reportó el efecto opuesto (60,7% VP vs 43,3% NE; OR 0,22; 95% IC 0,07-0,68)74. En la actualidad, la información científica disponible no avala la necesidad de ajustar la dosis de VP según el peso o índice de masa corporal75,76,77.
Comentarios finales
La suplementación de VP en dosis bajas constituye un abordaje terapéutico con sustento fisiológico para pacientes con shock séptico refractario a las medidas convencionales de reanimación, ya que no sólo actuaría sobre la deficiencia relativa de VP existente, sino que también participaría en la regulación de otros mecanismos involucrados en la vasoplejía.
La VP es una molécula compleja y sus efectos son dependientes del escenario clínico, el momento de inicio y las dosis utilizadas. Probablemente, el mejor balance riesgo/beneficio se obtenga con el empleo de dosis de suplementación de 0,01 a 0,03 U/min. El empleo de dosis más altas (0,04 a 0,06 U/min), puede asociarse a una mayor incidencia de lesiones cutáneas isquémicas. Se desaconseja la administración de dosis superiores a 0,06 U/min en pacientes con shock séptico. Los autores consideran que los datos actuales no respaldan el empleo de VP como vasopresor de primera línea en pacientes con shock séptico78. El objetivo de la adición de VP debiera ser la modulación de la cascada vasodilatadora, es decir como una terapia coadyuvante de soporte hemodinámico. La administración de VP como vasopresor único, con el objetivo de restablecer la PAM, se asocia a un mayor riesgo de eventos adversos y podría influir negativamente en el desenlace clínico.
En nuestra práctica clínica, consideramos la adición de VP (40 U en 100 ml de solución glucosada al 5%) a una dosis fija de suplementación de 0,03 U/min (4,5 ml/h) en pacientes con shock séptico, sin criterios de depresión miocárdica79 que, luego de optimizada la reanimación inicial, requieran una dosis de NE ?0,5 µg/kg/min en forma sostenida (?4 horas) y persistan con evidencia de hipoperfusión tisular (hiperlactatemia y/o llene capilar prolongado)80. Adicionalmente, una vez superada la fase aguda, en condiciones de estabilidad hemodinámica (PAM en meta con una dosis de NE <0,25 µg/kg/min) y restaurada la perfusión sistémica, iniciamos en primera instancia la reducción paulatina de VP (en pasos de 0,01 U/min), según tolerancia, continuando progresivamente hasta su suspensión en un lapso de 12 a 24 horas.
Referencias
1. Fleischmann C, Scherag A, Adhikari NK, et al. assessment of global incidence and mortality of hospital-treated sepsis. Current estimates and limitations. Am J Respir Crit Care Med 2016; 193: 259-272.
2. Rhee C, Dantes R, Epstein L. CDC Prevention Epicenter Program. Incidence and trends of sepsis in us hospitals using clinical vs claims data, 2009-2014. JAMA 2017; 318: 1241-1249.
3. Machado FR, Cavalcanti AB, Bozza FA. SPREAD Investigators; Latin American Sepsis Institute Network. The epidemiology of sepsis in Brazilian intensive care units (the Sepsis PREvalence Assessment Database, SPREAD): an observational study. Lancet Infect Dis 2017; 17: 1180-1189.
4. Levy MM, Evans LE, Rhodes A. The Surviving Sepsis Campaign Bundle: 2018 update. Intensive Care Med 2018; 44: 925-928.
5. Evans L, Rhodes A, Alhazzani W, et al. Surviving Sepsis Campaign: International guidelines for management of sepsis and septic shock 2021. Crit Care Med 2021; 49: e1063-e1143.
6. Romero CM, Luengo C, Regueira T, et al. Recomendaciones SOCHIMI para el manejo inicial de la sepsis. Rev Chil Med Intens 2017; 32: 107-126.
7. Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (Sepsis-3). JAMA 2016; 315: 801-810.
8. Bakker J, Kattan E, Annane D, et al. Current practice and evolving concepts in septic shock resuscitation. Intensive Care Med 2022; 48: 148-163.
9. Landry DW, Oliver JA. The pathogenesis of vasodilatory shock. N Engl J Med 2001; 345: 588-595.
10. Burgdorff AM, Bucher M, Schumann J. Vasoplegia in patients with sepsis and septic shock: pathways and mechanisms. J Int Med Res 2018; 46: 1303.
11. Romero CM, Hernández G. Actualización del bundle de reanimación inicial y monitorización integral de la perfusión tisular en la sepsis severa. Rev Med Chil 2013; 141: 1173-1181.
12. Holmes CL, Patel B, Russell J, Walley K. Physiology of vasopressin relevant to management of septic shock. Chest 2001; 120: 989-1002.
13. Holmes CL, Landry DW, Granton JT. Vasopressin and the cardiovascular system part 1 –receptor physiology. Critical Care 2003; 7: 427-434.
14. Lin IY, Ma HP, Lin AC, et al. Low plasma vasopressin/norepinephrine ratio predicts septic shock. Am J Emerg Med 2005; 23: 718-724.
15. Evora PR, Pearson PJ, Schaff HV. Arginine vasopressin induces endothelium-dependent vasodilatation of the pulmonary artery. V1-receptor-mediated production of nitric oxide. Chest 1993; 103: 1241-1245.
16. Okamura T, Toda M, Ayajiki K, Toda N. Receptor subtypes involved in relaxation and contraction by arginine vasopressin in canine isolated short posterior ciliary arteries. J Vasc Res 1997; 34: 464-472.
17. Okamura T, Ayajiki K, Fujioka H, Toda N. Mechanisms underlying arginine vasopressin-induced relaxation in monkey isolated coronary arteries. J Hypertens 1999; 17: 673-678.
18. Dünser MW, Ruokonen E, Pettilä V, et al. Association of arterial blood pressure and vasopressor load with septic shock mortality: A post hoc analysis of a multicenter trial. Crit Care 2009; 13: R181.
19. Brown SM, Lanspa MJ, Jones JP, et al. Survival after shock requiring high-dose vasopressor therapy. Chest 2013; 143: 664-671.
20. Brand DA, Patrick PA, Berger JT, et al. Intensity of vasopressor therapy for septic shock and the risk of in-hospital death. J Pain Symptom Manage 2017; 53: 938-943.
21. Sklar AH, Schrier RW. Central nervous system mediators of vasopressin release. Physiol Rev 1983; 63: 1243-1280.
22. Tsuneyoshi I, Yamada H, Kakihana Y, et al. Hemodynamic and metabolic effects of low-dose vasopressin infusions in vasodilatory septic shock. Crit Care Med 2001; 29: 487-493.
23. Edwards RM, Trizna W, Kinter LB. Renal microvascular effects of vasopressin and vasopressin antagonists. Am J Physiol 1989; 256: F274-F278.
24. Tamaki T, Kiyomoto K, He H, Tomohiro A, Nishiyama A, Aki Y, Kimura S, Abe Y. Vasodilation induced by vasopressin V2 receptor stimulation in afferent arterioles. Kidney Int 1996; 49: 722-729.
25. Fujiwara Y, Tanoue A, Tsujimoto G, Koshimizu TA. The roles of V1a vasopressin receptors in blood pressure homeostasis: A review of studies on V1a receptor knockout mice. Clin Exp Nephrol 2012; 16: 30-34.
26. Patel S, Rauf A, Khan H, Abu-Izneid T. Renin-angiotensin-aldosterone (RAAS): The ubiquitous system for homeostasis and pathologies. Biomed Pharmacother 2017; 94: 317-325.
27. Boyd JH, Holmes CL, Wang Y, et al. Vasopressin decreases sepsis-induced pulmonary inflammation through the V2R. Resuscitation 2008; 79: 325-331.
28. Russell JA, Fjell C, Hsu JL, et al. Vasopressin compared with norepinephrine augments the decline of plasma cytokine levels in septic shock. Am J Respir Crit Care Med 2013; 188: 356-364.
29. Juul KV, Bichet DG, Nielsen S, Nørgaard JP. The physiological and pathophysiological functions of renal and extrarenal vasopressin V2 receptors. Am J Physiol Renal Physiol 2014; 306: F931-F940.
30. Russ RD, Walker BR. Role of nitric oxide in vasopressinergic pulmonary vasodilatation. Am J Physiol 1992; 262: H743-H747.
31. Landry DW, Levin HR, Gallant EM, et al. Vasopressin pressor hypersensitivity in vasodilatory septic shock. Crit Care Med 1997; 25: 1279-1282.
32. Landry D, Levin H, Gallant E, et al. Vasopressin deficiency contributes to the vasodilation of septic shock. Circulation 1997; 95: 1122-1125.
33. Sharshar T, Carlier R, Blanchard A, et al. Depletion of neurohypophyseal content of vasopressin in septic shock. Crit Care Med 2002; 30: 497-500.
34. Day TA, Randle JC, Renaud LP. Opposing alpha- and beta-adrenergic mechanisms mediate dose-dependent actions of noradrenaline on supraoptic vasopressin neurones in vivo. Brain Res 1985; 358: 171-179.
35. Ukor IF, Walley KR. Vasopressin in Vasodilatory Shock. Crit Care Clin 2019; 35: 247-261.
36. Sharshar T, Blanchard A, Paillard M, et al. Circulating vasopressin levels in septic shock. Crit Care Med 2003; 31: 1752-1758.
37. Russell JA, Walley KR, Singer J; VASST Investigators. Vasopressin versus norepinephrine infusion in patients with septic shock. N Engl J Med 2008; 358: 877-887.
38. Malay MB, Ashton RC Jr, Landry DW, Townsend RN. Low-dose vasopressin in the treatment of vasodilatory septic shock. J Trauma 1999; 47: 699-703.
39. Sun Q, Dimopoulos G, Nguyen D, et al. Low-dose vasopressin in the treatment of septic shock in sheep. Am J Respir Crit Care Med 2003; 168: 481-486.
40. Romero C, Cornejo R, Mercado M, et al. Vasopresina en shock séptico severo hiperdinámico. Rev Chil Med Intensiva 2004; 19: 147.
41. Dubois MJ, De Backer D, Creteur J, et al. Effect of vasopressin on sublingual microcirculation in a patient with distributive shock. Intensive Care Med 2003; 29: 1020-1023.
42. Klinzing S, Simon M, Reinhart K, et al. High-dose vasopressin is not superior to norepinephrine in septic shock. Crit Care Med 2003; 31: 2646-2650.
43. Holmes CL, Walley KR, Chittock DR, et al. The effects of vasopressin on hemodynamics and renal function in severe septic shock: A case series. Intensive Care Med 2001; 27: 1416-1421.
44. Dünser MW, Mayr AJ, Ulmer H, et al. The effects of vasopressin on systemic hemodynamics in catecholamine-resistant septic and postcardiotomy shock: a retrospective analysis. Anesth Analg 2001; 93: 7-13.
45. Dünser MW, Mayr AJ, Tür A, et al. Ischemic skin lesions as a complication of continuous vasopressin infusion in catecholamine-resistant vasodilatory shock: Incidence and risk factors. Crit Care Med 2003; 31: 1394-1398.
46. Dünser M, Mayr A, Ulmer H, et al. Arginine vasopressin in advanced vasodilatory shock: A prospective, randomized, controlled study. Circulation 2003; 107: 2313-2319.
47. Luckner G, Dünser MW, Jochberger S, et al. Arginine vasopressin in 316 patients with advanced vasodilatory shock. Crit Care Med 2005; 33: 2659-2666.
48. Lauzier F, Lévy B, Lamarre P, Lesur O. Vasopressin or norepinephrine in early hyperdynamic septic shock: A randomized clinical trial. Intensive Care Med 2006; 32: 1782-1789.
49. Der-Nigoghossian C, Hammond DA, Ammar MA. Narrative review of controversies involving vasopressin use in septic shock and practical considerations. Ann Pharmacother 2020; 54: 706-714.
50. Russell JA, Walley KR, Gordon AC, et al. Interaction of vasopressin infusion, corticosteroid treatment, and mortality of septic shock. Crit Care Med 2009; 37: 811-818.
51. Gordon AC, Mason AJ, Perkins GD, et al. The interaction of vasopressin and corticosteroids in septic shock: a pilot randomized controlled trial. Crit Care Med 2014; 42: 1325-1333.
52. Gordon AC, Mason AJ, Thirunavukkarasu N; VANISH Investigators. Effect of early vasopressin vs norepinephrine on kidney failure in patients with septic shock: The vanish randomized clinical trial. JAMA 2016; 316: 509-518.
53. Gordon AC, Russell JA, Walley KR, et al. The effects of vasopressin on acute kidney injury in septic shock. Intensive Care Med 2010; 36: 83-91.
54. Stolk RF, van der Poll T, Angus DC, et al. Potentially inadvertent immunomodulation: norepinephrine use in sepsis. Am J Respir Crit Care Med 2016; 194: 550-558
55. Annane D, Ouanes-Besbes L, de Backer D, et al. A global perspective on vasoactive agents in shock. Intensive Care Med 2018; 44: 833-846.
56. Russell JA. Vasopressor therapy in critically ill patients with shock. Intensive Care Med 2019; 45: 1503-1517.
57. Asfar P, Meziani F, Hamel JF; SEPSISPAM Investigators. High versus low blood-pressure target in patients with septic shock. N Engl J Med 2014; 370: 1583-1593.
58. McIntyre WF, Um KJ, Alhazzani W, et al. Association of vasopressin plus catecholamine vasopressors vs catecholamines alone with atrial fibrillation in patients with distributive shock: A systematic review and meta-analysis. JAMA 2018; 319: 1889-1900.
59. Hajjar LA, Vincent JL, Barbosa Gomes Galas FR, et al. vasopressin versus norepinephrine in patients with vasoplegic shock after cardiac surgery: The VANCS randomized controlled trial. Anesthesiology 2017; 126: 85-93.
60. Hajjar LA, Zambolim C, Belletti A, et al. Vasopressin versus norepinephrine for the management of septic shock in cancer patients: The VANCS II randomized clinical trial. Crit Care Med 2019; 47: 1743-1750.
61. Nedel WL, Rech TH, Ribeiro RA, et al. Renal outcomes of vasopressin and its analogs in distributive shock: A systematic review and meta-analysis of randomized trials. Crit Care Med 2019; 47: e44-e51.
62. Nagendran M, Russell JA, Walley KR, et al. Vasopressin in septic shock: An individual patient data meta-analysis of randomised controlled trials. Intensive Care Med 2019; 45: 844-855.
63. Huang H, Wu C, Shen Q, et al. The effect of early vasopressin use on patients with septic shock: A systematic review and meta-analysis. Am J Emerg Med 2021; 48: 203-208.
64. Jiang L, Sheng Y, Feng X, Wu J. The effects and safety of vasopressin receptor agonists in patients with septic shock: A meta-analysis and trial sequential analysis. Crit Care 2019; 23: 91.
65. Jochberger S, Dörler J, Luckner G, et al. The vasopressin and copeptin response to infection, severe sepsis, and septic shock. Crit Care Med 2009; 37: 476-482.
66. Gomes DA, de Almeida Beltrão RL, de Oliveira Junior FM, et al. Vasopressin and copeptin release during sepsis and septic shock. Peptides 2021; 136: 170437.
67. Liu ZM, Chen J, Kou Q. Study Group of investigators. Terlipressin versus norepinephrine as infusion in patients with septic shock: A multicentre, randomised, double-blinded trial. Intensive Care Med 2018; 44: 1816-1825.
68. Li W, Pan P, Wang Y, et al. Effect of terlipressin on prognosis of adult septic shock patients: A Meta-analysis. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue 2020; 32: 134-139.
69. Laterre PF, Berry SM, Blemings A. SEPSIS-ACT Investigators. Effect of selepressin vs placebo on ventilator- and vasopressor-free days in patients with septic shock: The SEPSIS-ACT randomized clinical trial. JAMA 2019; 322: 1476-1485.
70. Wu JY, Stollings JL, Wheeler AP, et al. Efficacy and outcomes after vasopressin guideline implementation in septic shock. Ann Pharmacother 2017; 51: 13-20.
71. Kny KT, Ferreira MAP, Pizzol TDSD. Use of vasopressin in the treatment of refractory septic shock. Rev Bras Ter Intensiva 2018; 30: 423-428.
72. Hammond DA, Ficek OA, Painter JT, et al. Prospective open-label trial of early concomitant vasopressin and norepinephrine therapy versus initial norepinephrine monotherapy in septic shock. Pharmacotherapy 2018; 38: 531-538.
73. Jeon K, Song JU, Chung CR, et al. Incidence of hypotension according to the discontinuation order of vasopressors in the management of septic shock: A prospective randomized trial (DOVSS). Crit Care 2018; 22: 131.
74. Hammond DA, Sacha GL, Bissell BD, et al. Effects of norepinephrine and vasopressin discontinuation order in the recovery phase of septic shock: A systematic review and individual patient data meta-analysis. Pharmacotherapy 2019; 39: 544-552.
75. Hodge EK, Hughes DW, Attridge RL. Effect of body weight on hemodynamic response in patients receiving fixed-dose vasopressin for septic shock. Ann Pharmacother 2016; 50: 816-823.
76. Torbic H, Sacha GL, Bauer SR, Lam SW. Body mass’s impact on response to fixed-dose vasopressin in patients with septic shock. Shock 2018; 50: 388-394.
77. Dubrawka CA, Betthauser KD, Pope HE, Gibson GA. Effect of vasopressin dose on hemodynamic response in obese patients with septic shock: A retrospective observational study. Ann Pharmacother 2021; 55: 1447-1454.
78. Sandoval P, Luengo C, Romero CM. Inicio precoz de norepinefrina en shock séptico ¿tiene sustento clínico? Rev Chil Med Intensiva 2021; 36: 80-86.
79. Hernández G, Ospina-Tascón GA, Damiani LP, et al. Effect of a resuscitation strategy targeting peripheral perfusion status vs serum lactate levels on 28-day mortality among patients with septic shock: The ANDROMEDA-SHOCK Randomized Clinical Trial. JAMA 2019; 321: 654-664.
80. Geri G, Vignon P, Aubry A, et al. Cardiovascular clusters in septic shock combining clinical and echocardiographic parameters: A post hoc analysis. Intensive Care Med 2019; 45: 657-667.
¿CÓMO CITAR?
- APA
- Chicago
- Harvard
