Ultrasonografía Torácica en Cuidados Críticos
- Trabajo de Revisión
- 187 vistas
Resumen
La ultrasonografía torácica se ha convertido en una herramienta imprescindible en el manejo del paciente crítico, con ventajas respecto a la radiografía en cuanto a rendimiento diagnóstico y seguridad para el paciente, sobre todo con falla respiratoria aguda, permitiendo diagnósticos rápidos y certeros, basados en la identificación de artefactos que se originan en la interface pleural y por la pérdida de aireación pulmonar normal. De esta manera se identifican: Patrones normales, neumotórax, síndrome intersticial (edema pulmonar cardiogénico o inflamatorio), consolidación y derrame pleural. La aplicación de protocolos, como el protocolo BLUE (Bedside Lung Ultrasound Examination) permite un enfoque diagnóstico rápido, práctico y seguro para la mayoría de las patologías pleuro-pulmonares.
Palabras clave: Condensación pulmonar; Derrame pleural; Edema alveolo-intersticial; Evaluación ecográfica pulmonar; Neumotórax.
Abstract: Thoracic ultrasonography evaluation has become an essential tool in the management of critical care patients, with advantages over radiography in terms of diagnostic performance and safety for the patient, especially with acute respiratory failure, achieving rapid and accurate diagnoses, based on the identification of artifacts originating from the pleural interface and from loss of normal pulmonary aeration. Thus, normal pulmonary patterns, pneumothorax, interstitial syndrome (cardiogenic or inflammatory pulmonary edema), consolidation and pleural effusion are identified. The application of protocols, such as the BLUE protocol (Bedside Lung Ultrasound Examination) allows a fast, practical and safe diagnostic approach for most pleural-pulmonary pathologies.
Keywords: Alveolar-interstitial edema; Pleural effusion; Pneumothorax; Pulmonary condensation; Pulmonary ultrasound evaluation.
Introducción
La ultrasonografía (US) se ha convertido paulatinamente en una herramienta clave en el manejo moderno del paciente crítico. En especial, la US torácica que permite examinar el pulmón y el espacio pleural, logrando reducir la utilización de la radiografía y la tomografía axial computarizada (TAC)1 sin la necesidad de mover al paciente de la unidad y reduciendo los costos hasta en un 50%1.
Una de las principales causas de ingreso a la unidad de cuidados críticos en nuestro país es la falla respiratoria aguda en todos sus tipos2, permitiendo la US disminuir el uso de imágenes de manera importante, lo cual asociado a la rapidez y repetibilidad sin mayor radiación llevan a está técnica de imagen a ser la más eficiente, costo efectiva y segura dentro de cuidados críticos.
En esta revisión nos centraremos en los principales síndromes torácicos evaluables por US en el paciente crítico. En el pulmón revisaremos el síndrome intersticial y la consolidación, mientras que, en la pleura, el neumotórax y el derrame pleural.
Exploración
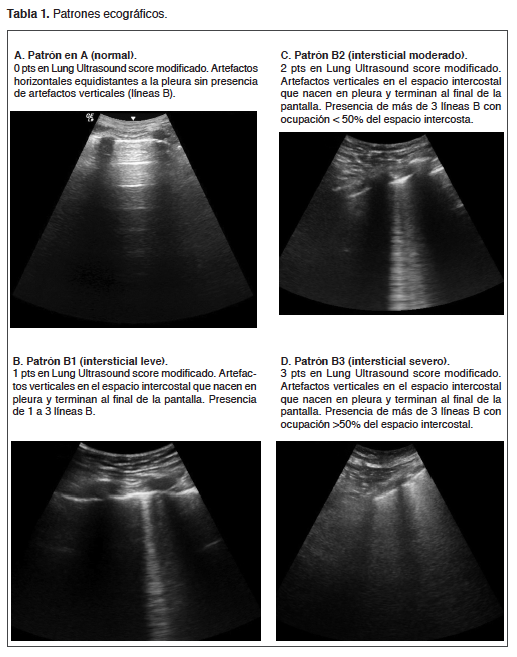
En pacientes críticamente enfermos, la visualización de la morfología pulmonar y la pérdida de aireación es crucial para apoyar la toma de decisiones y algunos procedimientos terapéuticos3. Aunque la radiografía de tórax se realiza de forma rutinaria, tiene un rendimiento diagnóstico limitado, por ende la TAC de pulmón sigue siendo el método de referencia, sin embargo, esta trae asociada el traslado del paciente y la exposición a radiación ionizante. La ecografía pulmonar se puede utilizar junto a la cama permitiendo un diagnóstico rápido y confiable de consolidación pulmonar, neumotórax, derrame pleural o síndrome intersticial-alveolar4 (Tabla 1). Por otro lado, al ser una técnica imagenológica libre de radiación ionizante, permite la visualización en vivo y de manera seriada de forma segura. Estas ventajas permiten que hoy en día se incluya a la US torácica dentro de las competencias básicas en la ecografía del paciente crítico5.
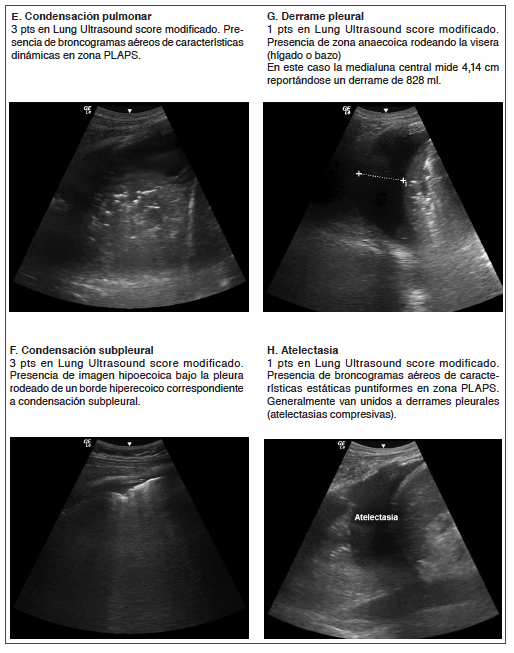
En cuanto a las zonas de exploración, existen diversos modelos reportados que van desde 3 a 6 zonas por pulmón contemplando la región ventral, lateral y posterior del tórax. Sin embargo, en el paciente críticamente enfermo se hace difícil la exploración de las regiones posteriores y es dependiente de la lateralización del mismo, por lo cual el abordaje de regiones posterolaterales en donde se visualice la base pulmonar contrastando la relación entre víscera-diafragma y pulmón, conocido como punto PLAPS (Postero-Lateral Alveolar and/or Pleural Syndrome) parece ser la exploración más favorable. En este contexto, un modelo coherente parece ser el descrito por Tierney (Figura 1)6. Este modelo de exploración permite clasificar cada zona evaluada otorgando puntaje para obtener un resultado sumatorio final logrando llevar a cabo de una manera más objetiva el seguimiento del compromiso pulmonar (lung ultrasound score) (Tabla 1). El puntaje de este score se correlaciona directamente con los días de ventilación mecánica, la estadía en UCI y hospital y la relación PaO2/FiO2 asociando un mayor puntaje a un peor desenlace.
La examinación se basará en pesquisar en las zonas no PLAPS la presencia de patrón en A, B o consolidaciones subpleurales. En el caso de los puntos PLAPS el examen se basa en pesquisar la eventual presencia de derrame pleural, consolidaciones pulmonares o atelectasias.
Diferentes sondas pueden ser adecuadas para la ultrasonografía pulmonar; la elección de la más adecuada depende del tamaño del paciente y de la patología sospechada. Las sondas lineales tienen alta definición superficial y baja capacidad de penetración; por tanto, son adecuadas en pacientes con patologías pleurales (es decir, neumotórax). Las sondas phased-array y convexas son más adecuadas para el examen de patologías profundas (consolidaciones y derrames pleurales) y para áreas gruesas de la pared parietal, principalmente lateral y posterior.
US de pulmón normal (Tabla 1 A)
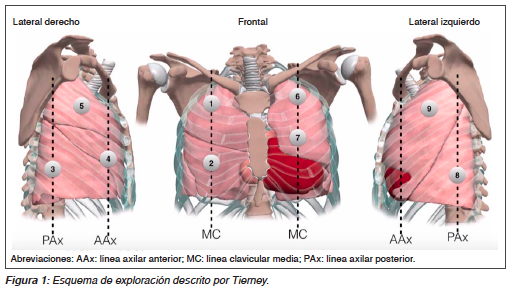
Los haces ultrasónicos no se transmiten a través del pulmón normalmente aireado y solo se puede ver la línea pleural. Aparece como una línea hiperecoica y deslizante, moviéndose con la ventilación, resultado del deslizamiento de la pleura parietal y visceral durante el ciclo respiratorio. Bajo la pleura se visualizan líneas horizontales inmóviles y espaciadas de manera equidistante hacia la pleura, llamadas líneas A que corresponden al artefacto de reverberación normal de la línea pleural. Las líneas A y el deslizamiento pleural definen la aireación normal. Existe además una modalidad ecográfica llamada modo M que permite analizar cualitativa y cuantitativamente el movimiento de las estructuras del cuerpo a analizar. En este modo el pulmón normal se visualiza como el “signo de la playa”, en donde la pared torácica simula el mar, la línea pleural la orilla de la playa y el pulmón en movimiento genera un artefacto granular que aparenta ser la arena de la playa (Figura 2).
Neumotórax
Los signos sonográficos del neumotórax incluyen la combinación de ausencia de deslizamiento pulmonar, presencia exclusiva de líneas A o ausencia de líneas B, ausencia de pulso pulmonar y la identificación del punto pulmonar7,8.
La presencia de deslizamiento pulmonar, líneas B o pulso pulmonar descartan el neumotórax, ya que estos signos requieren que las dos hojas pleurales estén en contacto directo. El deslizamiento pulmonar descarta la presencia de neumotórax en el sitio examinado, con un valor predictivo negativo del 100%9. Sin embargo, su ausencia no permite excluirlo ya que otras entidades como la pleurodesis, contusión, enfermedad severa del parénquima pulmonar, distrés respiratorio, bulas gigantes, oclusión o la intubación monobronquial pueden abolirlo10,11.
Mientras que la ausencia de deslizamiento pulmonar sugiere la posibilidad de neumotórax, la presencia del punto pulmonar, sitio donde vuelven a unirse ambas hojas pleurales y se deslizan con el movimiento ventilatorio, lo diagnostica, con una especificidad del 100% pero sensibilidad del 60%7,11. Su localización permite una estimación semi-cuantitativa de la extensión del mismo, siendo pequeño si se localiza en cara anterior del tórax con el paciente en decúbito supino (límite establecido por la línea axilar anterior) y extenso si se encuentra en cara lateral12. Sin embargo, cuando es lo suficientemente grande como para rodear toda la superficie pulmonar, el punto pulmonar desaparece, por tal motivo no debe buscarse en situaciones de emergencia, en donde basta la ausencia de cualquier movimiento horizontal (deslizamiento) o vertical (pulso) de la línea pleural, junto con la ausencia de líneas B para plantear de forma segura el diagnóstico de neumotórax8,10.
Con el paciente en decúbito supino y un transductor curvilíneo o linear, se exploran las zonas anteriores menos dependiente, a nivel del 3er y 4to espacio intercostal entre línea paraesternal y medioclavicular, fijando el foco a la altura de la pleura parietal, generalmente 0,5 cm debajo de la superficie costal. El plano inicial debe ser longitudinal, permitiendo la visualización de 2 arcos costales y el espacio intercostal correspondiente, lo cual facilita, sobre todo para principiantes, la pronta identificación del principal objetivo, la línea pleural y así evitar confundirla con el borde hiperecogénico de la superficie costal10,13. Una vez identificada la línea pleural se debe rotar ligeramente el transductor para obtener un plano oblicuo que corresponde con el eje largo del espacio intercostal, esto permite explorar una mayor superficie pleural10.
De forma ordenada, una vez identificada la ausencia de deslizamiento pulmonar y presencia exclusiva de líneas A, se progresa lateralmente en busca del punto pulmonar (con paciente estable) y determinar envergadura de este (pequeño o extenso) con buena correlación en cuanto a evaluación de extensión brindada por la tomografía. En modo M (modo movimiento) se comprueba la ausencia de deslizamiento pulmonar con el signo de la estratosfera o código de barras (Figura 2) y puede usarse como complemento a la imagen en 2D14 (Figura 3).
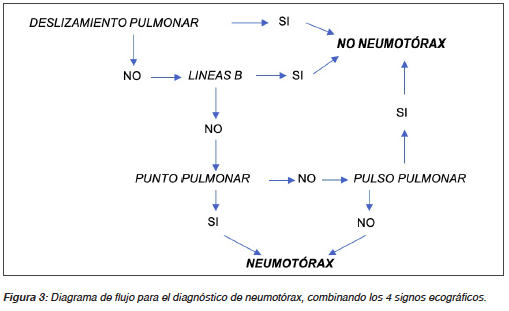
Síndrome Intersticial Sonográfico (Tabla 1 B, C y D)
El síndrome intersticial sonográfico se define por la presencia de múltiples líneas B, difusas y bilaterales (perfil B)8. Estos artefactos aparecen siempre que disminuya la aireación pulmonar subpleural por fibrosis (líneas B secas), inflamación o edema (líneas B húmedas). Su distribución y características (número, distancia entre ellas y origen) así como hallazgos asociados sirven para identificar el edema intersticial, la neumonía intersticial, la fibrosis pulmonar y el edema pulmonar cardiogénico o de alta permeabilidad15. En caso de neumonías, infartos o contusiones puede aparecer un patrón similar pero focal y por lo tanto no se incluye dentro del síndrome16.
Se considera un patrón B cuando están afectadas bilateralmente 2 o más de las 8 regiones a explorar, 4 en cada hemitórax. Una región se considera positiva si tienen 3 o más líneas B en el plano longitudinal entre dos arcos costales8. Su número y extensión permiten una estimación semicuantitativa del agua extravascular pulmonar (ausente si menos de 5 a edema severo si más de 30 líneas B)17. En situación de emergencia basta con explorar 4 zonas (2 a cada lado en cara anterior) aunque la exactitud diagnóstica aumenta con mayor número de zonas exploradas sobre todo para falla cardiaca aguda18.
El hallazgo de un patrón B nos alerta sobre la intolerancia a la reanimación con fluidos. Según su distribución y características se puede diferenciar entre cardiogénico o inflamatorio16. En el síndrome de distrés respiratorio agudo, generalmente la distribución del perfil B es no homogénea (áreas de aireación normal rodeadas de líneas B), existen consolidaciones subpleurales, zonas de línea pleural engrosadas e irregulares que producen ausencia o disminución del deslizamiento pulmonar y generalmente ausencia de derrame pleural15. En esta entidad, la ecografía permite, además, identificar el patrón de pérdida de aireación (focal o difusa) y complementa la optimización de la ventilación mecánica19.
La relación entre las líneas B y la presión de oclusión de la arteria pulmonar es menos específica que su relación con el agua extravascular pulmonar detectada por termodilución, así, la ecografía pulmonar puede usarse para descartar la congestión pulmonar, sin embargo, el paciente puede presentar un aumento de presión de capilar pulmonar en ausencia de líneas B por lo que se debe complementar el estudio con ecocardiografía16.
Por último, se debe considerar que no siempre es posible una adecuada evaluación sonográfica de nuestros pacientes, sobre todo para evaluar las áreas posteriores, incluso las laterales, por presencia de tubos pleurales, enfisema subcutáneo, edema de pared y adhesivos.
Consolidación pulmonar (Tabla 1 E y F)
La consolidación pulmonar se debe a una pérdida masiva de aireación, como en la bronconeumonía lobar, contusión pulmonar y atelectasia lobar. Aparece como una ecotextura similar a un tejido (“hepatización”). Dentro de la consolidación se pueden observar imágenes puntiformes hiperecoicas, correspondientes a broncogramas aéreos (bronquios llenos de aire tabla 1 e). La penetración de gas en el árbol bronquial de la consolidación durante la inspiración produce un refuerzo inspiratorio de estas imágenes puntiformes hiperecoicas (broncogramas dinámicos)20,21. En un estudio, el broncograma aéreo dinámico estaba presentes en 32 de 33 pacientes ingresados con neumonía aguda22. Por otra parte estas consolidaciones no solo se pueden ver presentes en la zona PLAPS sino que también en las otra regiones presentándose muchas veces como condensaciones subpleurales (Tabla 1 F).
Derrame Pleural (Tabla 1 G)
El derrame pleural es tremendamente frecuente en la unidad de cuidados críticos. Cuando se ha revisado la prevalencia en pacientes de unidad de cuidados críticos, se ha hecho evidente hasta en un 60%, con prevalencia al ingreso de un 40%23. Esta patología genera mayores tiempos de permanencia en ventilación mecánica, mayor falla en el weaning y mayor mortalidad24.
La US es mejor que la radiografía de tórax para detectar la presencia de derrame pleural (se pueden detectar derrames pleurales desde los 5 ml), determinar su volumen, predecir las características del líquido y determinar el sitio de punción25.
Al momento de decidir la punción, se debe elegir el sitio con mayor distancia entre pleuras parietal y visceral, además de estar alejados de bazo, hígado, corazón o pulmón. Se pueden puncionar derrames que tengan un grosor mayor a 10 mm. No es absolutamente necesaria la punción guiada por ecografía en tiempo real, pero se debe identificar de manera previa a la toracocentesis, la trayectoria y profundidad de la pleura parietal, y estructuras vecinas26,27. El riesgo de neumotórax por toracocentesis bajo presión positiva es relativamente bajo, rondando el 2%28.
El operador puede acercarse a la identificación de un exudado o trasudado por la US pleural, junto con estimar el tamaño del derrame pleural. Los trasudados tienden a ser anecoicos, aunque un 40% de los derrames anecoicos pueden ser exudado29. Por otro lado, si existen septos o material heterogéneo en su interior es altamente probable que estemos frente a un exudado29.
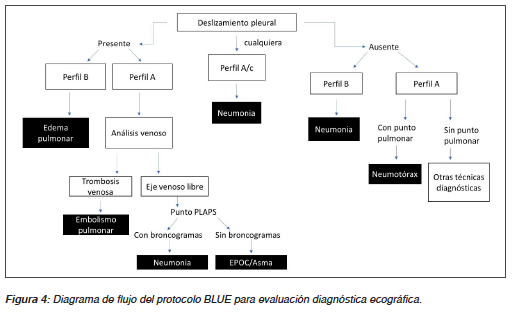
Toda esta información comentada en esta revisión se consolida en un esquema de diagnóstico ultrasonográfico pulmonar llamado protocolo BLUE, el cual se muestra en la figura 4. Este esquema por vía US presenta una seguridad diagnóstica > 90%30.
Conclusión
El uso de la US torácica por sí sola en intensivo permite diagnósticos rápidos y una guía en el manejo en tiempo real. Gracias a su repetibilidad sin riesgo para el paciente, facilidad de uso y confiabilidad la han llevado a ser el examen de elección para múltiples patologías torácicas, llegando a sobrepasar para varias condiciones torácicas en sensibilidad y especificidad a la radiografía de tórax.
Lo anterior sumado a las otras herramientas de la US de cuidados críticos, permite una evaluación global del enfermo, convirtiéndola en una herramienta de trabajo diario y en el nuevo estetoscopio.
Referencias
1. Brogi E, Bignami E, Sidoti A, et al. Could the use of bedside lung ultrasound reduce the number of chest x-rays in the intensive care unit? Cardiovasc Ultrasound, 2017; 15(1): 1-5.
2. Ruiz C, Díaz MÁ, Zapata JM, et al. Characteristics and evolution of patients admitted to a public hospital intensive care unit. Rev Med Chile, 2016; 144(10): 1297-1304.
3. Rouby JJ, Constantin JM, Girardi CRDA, Zhang M, Lu Q. Mechanical ventilation in patients with acute respiratory distress syndrome. Anesthesiology, 2004; 101(1): 228-234.
4. Lichtenstein D, Goldstein I, Mourgeon E, Cluzel P, Grenier P, Rouby JJ. Comparative diagnostic performances of auscultation, chest radiography and lung ultrasonography in acute respiratory distress syndrome. Anesthesiology, 2004; 100(1): 9-15.
5. Mayo PH, Beaulieu Y, Doelken P, et al. American college of chest physicians/ la societédé réanimation de langue française statement on competence in critical care ultrasonography. Chest, 2009; 135(4): 1050-1060.
6. Tierney DM, Boland LL, Overgaard JD, et al. Pulmonary ultrasound scoring system for intubated critically ill patients and its association with clinical metrics and mortality: A prospective cohort study. J Clin Ultrasound, 2018; 46(1): 14-22.
7. Lichtenstein D, Mezière G, Biderman P, Gepner A. The “lung point”: An ultrasound sign specific to pneumothorax. Intensive Care Med, 2000; 26(10): 1434-1440.
8. Volpicelli G, Elbarbary M, Blaivas M, et al. International evidence-based recommendations for point-of-care lung ultrasound. Intensive Care Med, 2012; 38(4): 577-591.
9. Lichtenstein DA, Menu Y. A bedside ultrasound sign ruling out pneumothorax in the critically ill: Lung sliding. Chest, 1995; 108(5): 1345-1348.
10. Husain LF, Hagopian L, Wayman D, Baker WE, Carmody KA. Sonographic diagnosis of pneumothorax. J Emerg Trauma Shock, 2012; 5(1): 76-81.
11. Mayo PH, Copetti R, Feller-Kopman D, et al. Thoracic ultrasonography: a narrative review. Intensive Care Med, 2019; 45(9): 1200-1211.
12. Volpicelli G, Boero E, Sverzellati N, et al. Semi-quantification of pneumothorax volume by lung ultrasound. Intensive Care Med, 2014; 40(10): 1460-1467.
13. Ball CG, Kirkpatrick AW, Laupland KB, et al. Factors related to the failure of radiographic recognition of occult posttraumatic pneumothoraces. Am J Surg, 2005; 189 (5 SPEC. ISS.): 541-546.
14. Avila J, Smith B, Mead T, et al. Does the addition of M-mode to B-mode ultrasound increase the accuracy of identification of lung sliding in traumatic pneumothoraces? J Ultrasound Med, 2018; 37(11): 2681-2687.
15. Bellani G, Rouby JJ, Constantin JM, Pesenti A. Looking closer at acute respiratory distress syndrome: The role of advanced imaging techniques. Curr Opin Crit Care, 2017; 23(1): 30-37.
16. Volpicelli G, Skurzak S, Boero E, et al. Lung ultrasound predicts well Extravascular lung water but is of limited usefulness in the prediction of wedge pressure. Anesthesiology, 2014; 121(2): 320-327.
17. Picano E, Pellikka PA. Ultrasound of extravascular lung water: A new standard for pulmonary congestion. Eur Heart J, 2016; 37(27): 2097-2104.
18. Buessler A, Chouihed T, Duarte K, et al. Accuracy of Several Lung Ultrasound Methods for the Diagnosis of Acute Heart Failure in the ED: A Multicenter Prospective Study. Chest, 2020; 157(1): 99-110.
19. Luecke T, Corradi F, Pelosi P. Lung imaging for titration of mechanical ventilation. Curr Opin Anaesthesiol, 2012; 25(2): 131-140.
20. Lichtenstein D, Mezière G, Seitz J. The dynamic air bronchogram: A lung ultrasound sign of alveolar consolidation ruling out atelectasis. Chest, 2009; 135(6): 1421-1425.
21. Gillman LM, Panebianco N, Alkadi A, Blaivas M, Kirkpatrick AW. The dynamic sonographic air bronchogram: A simple and immediate bedside diagnosis of alveolar consolidation in severe respiratory failure. J Trauma - Inj Infect Crit Care, 2011; 70(3): 760.
22. Reissig A, Kroegel C. Sonographic diagnosis and follow-up of pneumonia: A prospective study. Respiration, 2007; 74(5): 537-547.
23. Mattison LE, Coppage L, Alderman DF, Herlong JO, Salm SA. Pleural effusions in the medical ICU: Prevalence, causes and clinical implications. Chest, 1997; 111(4): 1018-1023.
24. Razazi K, Boissier F, Neuville M, et al. Pleural effusion during weaning from mechanical ventilation: Aprospective observational multicenter study. Ann Intensive Care, 2018; 8(1): 103.
25. Yu CJ, Yang PC, Chang DB, Luh KT. Diagnostic and therapeutic use of chest sonography: Value in critically ill patients. Am J Roentgenol, 1992; 159(4): 695-701.
26. Feller-Kopman D. Ultrasound-guided thoracentesis. Chest, 2006; 129(6): 1709-1714.
27. Millington SJ, Koenig S. Better With Ultrasound: Pleural Procedures in Critically Ill Patients. Chest, 2018; 153(1): 224-232.
28. Mayo PH, Goltz HR, Tafreshi M, Doelken P. Safety of ultrasound-guided thoracentesis in patients receiving mechanical ventilation. Chest, 2004; 125(3): 1059-1062.
29. Yang PC, Luh KT, Chang DB, Wu HD, Yu CJ, Kuo SH. Value of sonography in determining the nature of pleural effusion: Analysis of 320 cases. Am J Roentgenol, 1992; 159(1): 29-33.
30. Lichtenstein DA, Mezière GA. Relevance of lung ultrasound in the diagnosis of acute respiratory failure the BLUE protocol. Chest, 2008; 134(1): 117-125.
¿CÓMO CITAR?
- APA
- Chicago
- Harvard
