Rol de la milrinona en el tratamiento del shock séptico
- Trabajo Original
- 12761 vistas
Resumen
Introducción: Los agentes inotrópicos más utilizados en la UCI son la dobuta- mina (DBT) y la milrinona (MN); desafortunadamente, han mostrado efectos secundarios significativos cuando se usan para la depresión miocárdica durante el shock séptico (SS). Nuestro objetivo es describir el comportamiento de MN en SS. Métodos: Se revisaron 83 historias clínicas de pacientes que recibieron milrinona y presentaban SS con depresión miocárdica o alteración de los parámetros metabólicos y perfusión clínica al ingreso, de enero a diciembre de 2013. Once fueron excluidos por tener cardiopatía conocida o no tener datos completos. Se registraron datos demográficos, hemodinámicos, metabólicos y gaso- métricos antes y después de la infusión de MN. Se utilizó el sistema de monitoreo PiCCO. Para optimizar el análisis, los pacientes se dividieron en 2 grupos: grupo norepinefrina (NE)Introducción: Los agentes inotrópicos más utilizados en la UCI son la dobuta- mina (DBT) y la milrinona (MN); desafortunadamente, han mostrado efectos secundarios significativos cuando se usan para la depresión miocárdica durante el shock séptico (SS). Nuestro objetivo es describir el comportamiento de MN en SS. Métodos: Se revisaron 83 historias clínicas de pacientes que recibieron milrinona y presentaban SS con depresión miocárdica o alteración de los parámetros metabólicos y perfusión clínica al ingreso, de enero a diciembre de 2013. Once fueron excluidos por tener cardiopatía conocida o no tener datos completos. Se registraron datos demográficos, hemodinámicos, metabólicos y gaso- métricos antes y después de la infusión de MN. Se utilizó el sistema de monitoreo PiCCO. Para optimizar el análisis, los pacientes se dividieron en 2 grupos: grupo norepinefrina (NE)+ MN (57 pacientes) y grupo NE, MN y DBT (15 pacientes). Los datos se expresan como media y desviación estándar y mediana rango para los datos no paramétricos. El análisis estadístico utilizó la prueba t de Student para análisis paramétrico y Wilcoxon para datos no paramétricos. Se utilizó la prueba de Friedman para comparaciones múltiplos. P<0,05 se consideró significativo. Resultados: Se analizaron 72 pacientes. El 34,4% eran mujeres. La edad, APACHE II, días de ventilación mecánica y tiempo de estancia en UCI fueron: 67±16 años, 18,4±5,9 puntos, 14,9±12,9 y 23,1±19,9 días, respectivamente. En el grupo total, las variables antes y después del inicio de la NM mostraron: incremento del IC: 3,1±1 a 3,3±1,1L/min/m2 (p= 0,003), frecuencia cardíaca: 82,4±14,4 a 88,3±18,1 lpm (p= 0,002), reduccióndel DPaCO2: 7,63±3,3 a 6,04±3,6 mmHg (p= 0,03); incrementó de la SvcO2: 71,1±10,3 a76,1±7,3% (p= 0,004), reducción del lactato arterial: 18,8±14,9 a 13,1±9,1 mg/dL (p= 0,01) e incremento de la diuresis: 1069,5±945,5 a 1490±1242,5 (p=0,0003). El 20,8% de los pacientes estaban recibiendo DBT simultáneamente. La mortalidad en la UCI fue del 23%. Después de la infusión de MN: CVP, MAP, SVRI, ITBV y EVLWI no mostraron diferencias significativas. La dosis media de MN fue de 0,30±0,14 µg/kg/min. La norepinefrina antes y después de la infusión de MN no mostró diferencias significativas: 0,19±0,2 versus 0,2±0,26 µg/kg/min (p= 0,85) De los pacientes que usaron NAD y MN, 17,2% desarrollaron fibrilación auricular (FA), mientras que en el grupo que utilizó DBT+MN+NAD alcanzó un 26,6% (p= 0,49). Conclusión: MN optimiza el rendimiento cardiovascular en SS con DM, como lo demuestra la mejoría del IC, ScvO2, DPaCO2, ácido láctico y diuresis. Sin embargo, los pacientes de ambos grupos desarrollaron fibrilación auricular.
Palabras clave: Choque; Hemodinamica; Milrinona; Sépsis.
Introducción
Actualmente se reconoce la presencia de disfunción miocárdica (DM) en el shock séptico (SS). Parker et al. publicaron 20 pacientes con SS en la cual un 50% de ellos cursó con una fracción de eyección del ventrículo izquierdo (FEVI) menor del 40%1. En 2006 se aceptaba que hasta un 50% de los pacientes con SS podían tener algún grado de DM2. Sin embargo, la prevalencia ha sido variable dependiendo del método de evaluación3: gasto cardiaco (GC), troponinas T e I, Péptido Natriurético B o ecocardiografía4.
En 2008 Vieillard-Baron et al. estudiaron 67 pacientes con SS sin antecedentes de cardiopatía previa con ecocardiografía transesofágica. Ellos estimaron una incidencia promedio de DM de 60%, que se manifiesta en las primeras 48 horas de evolución5,6 y se recupera entre los 7 y 10 días post-inicio del SS3.
Jardin et al. evaluaron mediante ecocardiografía a pacientes en SS y demostraron que estos presentaban un volumen de fin de diástole normal, pero con volúmenes de eyección disminuidos y los que sobreviven presentan alteraciones más marcadas de la función ventricular al inicio del cuadro, recuperando la FEVI una vez resuelto el SS7.
En 1980 se planteó la presencia de un factor circulante depresor miocárdico, el cual fue confirmado por Parrillo et al. al demostrar que el suero obtenido durante la fase aguda de pacientes con SS era capaz de disminuir la velocidad de acortamiento de cardiomiocitos de rata in vitro, mientras que el suero de pacientes no sépticos restauraba su función8. Hoy se responsabiliza a las interleucinas 1 (IL-1), IL-2, IL-6 y al factor de necrosis tumoral alfa como los depresores miocárdicos circulantes9. Existe también evidencia de activación de vías apoptóticas que deterioran la función mitocondrial del cardiomiocito. Asimismo, hay adhesión de leucocitos activados en el cardiomiocito vía moléculas de adhesión intercelular que inducen disfunción y finalmente la muerte del cardiomiocito10.
Por otra parte, la miofibrilla muestra una sensibilidad disminuida al calcio, explicada probablemente por la fosforilación de la Troponina I en el sitio donde se combina con el calcio11. Además, se reconoce que la DM se asocia a incremento de óxido nítrico (ON) intracelular, el cual juega un papel indirecto a través de la formación de peroxinitrito, cuya inhibición produce mejoría en la DM12. Dado lo anterior, se postula que la DM podría explicarse tanto por factores intra como extracardíacos, descartando la hipótesis asociada a hipoperfusión, ya que el flujo sanguíneo coronario en el SS, se encuentra preservado13.
El uso de drogas inotrópicas en el manejo del SS debería inducir mejoría en los índices de función ventricular, aumento en la SvO2/ScvO2 y reducción de los niveles de lactato sérico. Dobutamina (DBT) sigue siendo el fármaco recomendado por la Surviving Sepsis Campaign para tratar la DM séptica14. Sin embargo, los agentes b1-agonistas pueden ser menos efectivos cuando se produce down regulation de dichos receptores, oxidación de catecolaminas por aumento del estrés oxidativo, e inhibición de la proteína G asociada al receptor b1-adrenérgico que impide la activación de la adenilatociclasa15. Se han demostrado taquiarritmias y aumento del consumo de O2 miocárdico, sobre todo en pacientes en SS con presiones de llenado bajas16. Por otra parte, Kumar et al. demostraron que DBT aumenta la FEVI más de 10% sólo en un 35% de estos pacientes17.
Milrinona (MN), al ser un inhibidor de la fosfodiesterasa III, ejerce un efecto inotrópico incrementando el AMPc en el citosol de los cardiomiocitos; sin embargo, por su efecto vasodilatador sistémico, no ha sido ampliamente recomendada en DM séptica18,19,20.
Basados en la literatura disponible, nuestro grupo incorporó estas drogas en el tratamiento de del SS con DM. Nuestro objetivo fue establecer el impacto hemodinámico de MN en una población de pacientes con SS.
Material y métodos
Estudio de cohorte retrospectivo donde se revisaron las fichas de todos los pacientes mayores de 18 años con diagnóstico de shock séptico (SS) que requirieron ventilación mecánica (VM) por más de 24 h y que recibieron MN como parte del tratamiento del SS, que ingresaron al centro de pacientes críticos de Clínica Indisa entre el 1° de enero y 31 de diciembre de 2013. Se reunieron 83 pacientes de los cuales 11 fueron excluidos por poseer antecedentes de cardio- patía conocida o no contaban con mediciones completas, quedando 72 para el análisis. Todos los pacientes se encontraban monitorizados con catéter venoso central y sistema PiCCO21. Para objetivar el impacto de la inclusión de MN al esquema vasoactivo, se registraron variables demográficas, gasométricas, hemodinámicas, metabólicas (lactato, SvcO2, diferencia de CO2 Veno-Arterial [△CO2], exceso de base [BE]) y diuresis de 24 horas antes y después de iniciar la administración de MN. Se consignó si los pacientes estaban recibiendo DBT.
En cada paciente se consideraron los perfiles hemodinámicos pre y post infusión de MN. Las mediciones se recolectaron entre 1 a 3 horas antes de la introducción de MN y 4 a 6 horas después (post 1), luego cada 6 horas hasta completar 24 horas (post 2, 3 y 4) en posición supina, ventilados con modo A/C. Los GC fueron medidos en triplicado con inyección de 15 ml de solución salina fría (<8°C), descartándose el valor cuya diferencia fuese mayor al 10% (protocolo UCI). La conducta clínica fue guiada por los valores de IC y volumen sanguíneo intra- torácico (ITBV), los datos fueron indexados por superficie corporal. Para optimizar el análisis, los pacientes fueron divididos en: grupo total; grupo de pacientes que estaban recibiendo DBT al momento de introducir MN y pacientes que se encontraban sólo con noradrenalina (NAD) al iniciar la infusión de MN. Para las variables paramétricas los resultados son expresados como promedio más desviación estándar y para las comparaciones se utilizó t de student para muestras pareadas. Para las variables no paramétricas los resultados son expresados en mediana (rango) y las comparaciones fueron realizadas con prueba de Wilcoxon. Para ana- lizar las variables en el tiempo se utilizó test de Friedman para medidas repetidas. Se consideró significativo una p≤0,05. Se utilizó el programa SPSS 21. Todos los pacientes o los familiares responsables firmaron un consentimiento infor- mado al ingresar a UCI.
Resultados
Se analizaron 72 pacientes cuya edad, APACHE II de ingreso, estadía en VM y UCI fueron: 67±16 años; 18,4±5,9 puntos; 14,9±12,9 y 23,1±19,9 días respectivamente, 34,4% fueron mujeres. La mortalidad en UCI fue 23%. La distribución según el foco de la sepsis, en la figura 1. El 20,8% de los pacientes se encontra- ba recibiendo DBT al momento de incluir MN.
Las variables analizadas en el grupo total se describen en la tabla 1. En este grupo des- tacan las diferencias significativas en el IC, FC, DCO2 V-A, láctico, SvcO2 y en la diuresis de 24 horas pre y post inicio de MN. En el grupo que se encontraba recibiendo DBT de manera concomitante (20,8%), hubo mejoría en el IC (incremento de 9,02±2,9%) y en el láctico arterial (reducción de 15,2±11,8%) después de iniciar la MN (Tablas 2 y 3). En el grupo que utilizó solo NAD con milrinona, luego de iniciar la infusión de milrinona se observó una mejoría en el IC, DCO2 V-A y en la SvcO2 (Tablas 2 y 3). El in- cremento del IC inducido por MN se mantuvo en las siguientes 24 horas, mientras los otros parámetros hemodinámicos: (ITBV; RVSI y EVLWI) no mostraron variaciones significativas en el tiempo (Figura 2).
La dosis de NAD antes de incorporar MN en el grupo milrinona y en el grupo milrinona más DBT se describen en la tabla 4. Del total de pa- cientes, a 27 se les practicó ecocardiografía de superficie al ingreso, siendo el promedio de la FEVI de 51±17,7%. Trece pacientes requirieron terapias de reemplazo renal (17%).
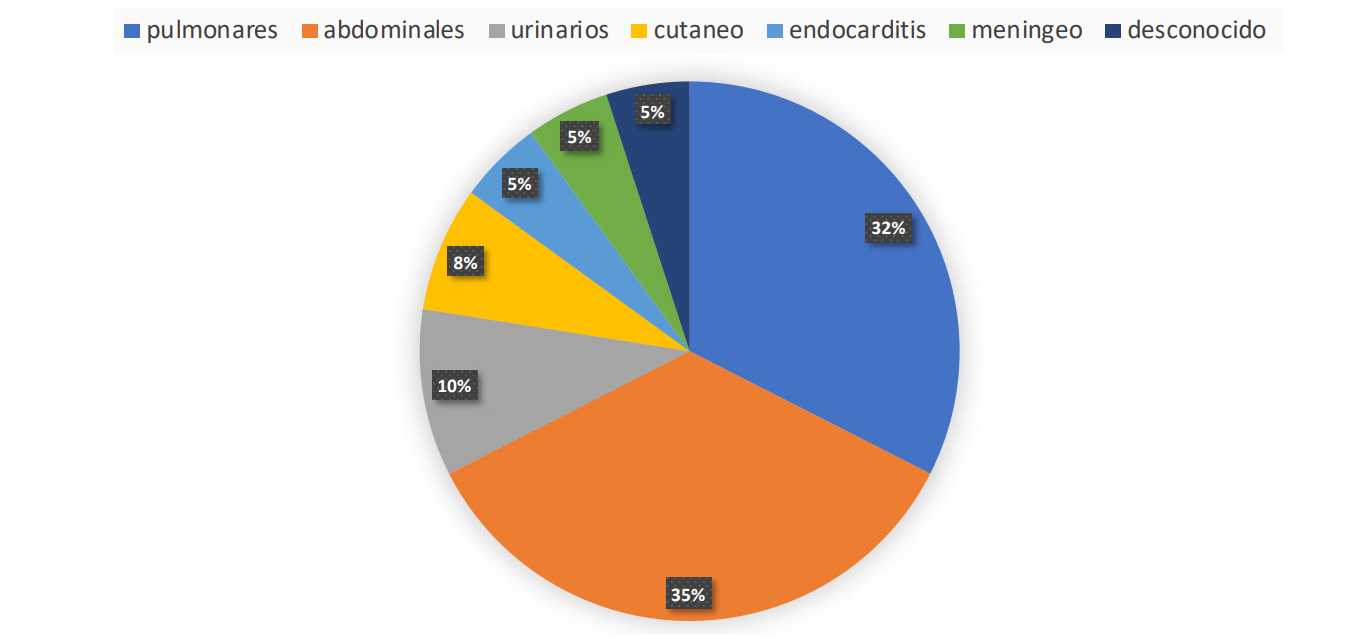
Figura 1: Distribución según foco del SS.
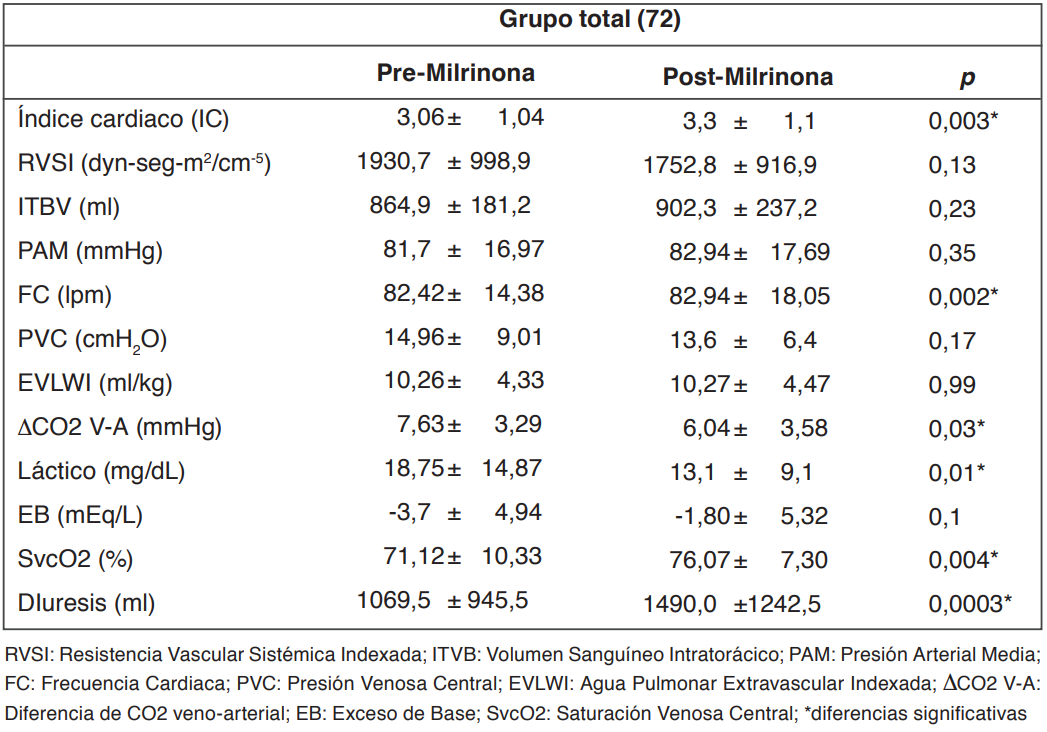
Tabla 1. Parámetros hemodinámicos y metabólicos pre y post inicio de milrinona.
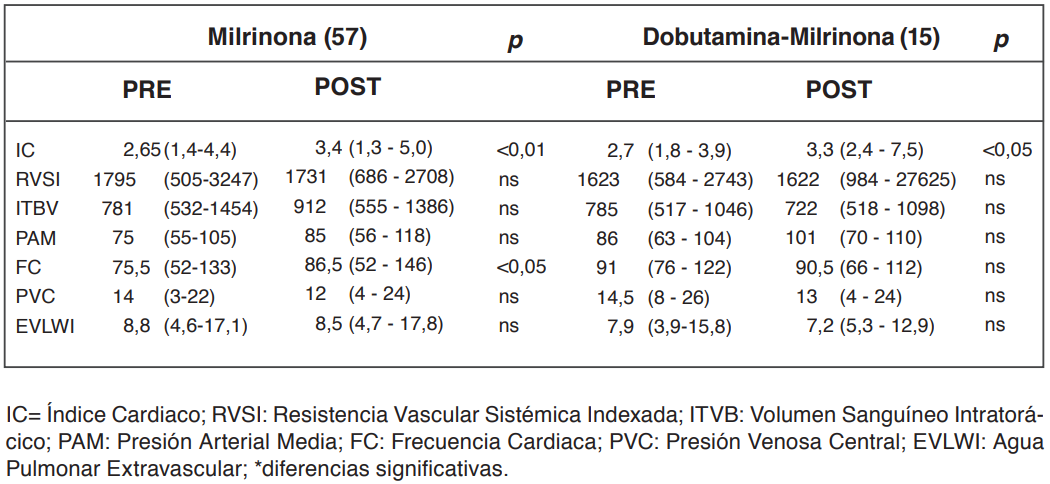
Tabla 2. Parámetros hemodinámicos pre y post inicio de la infusión de milrinona.
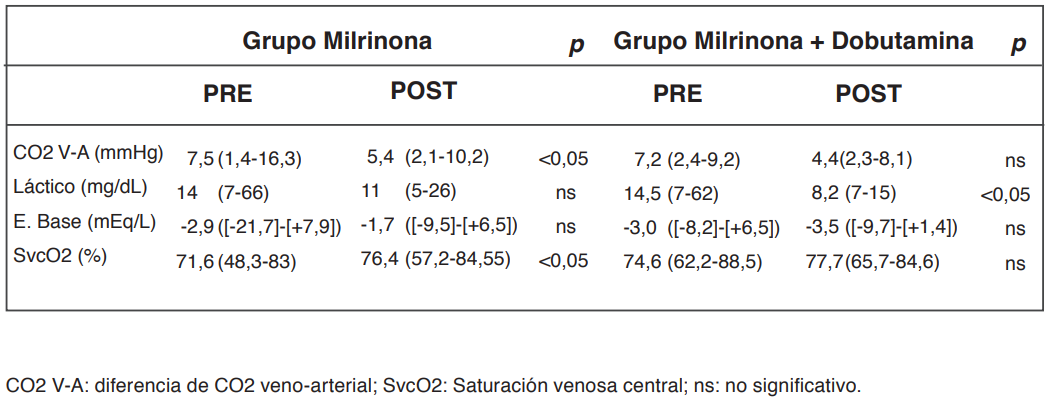
Tabla 3. Parámetros metabólicos pre y post inicio de la infusión de milrinona.
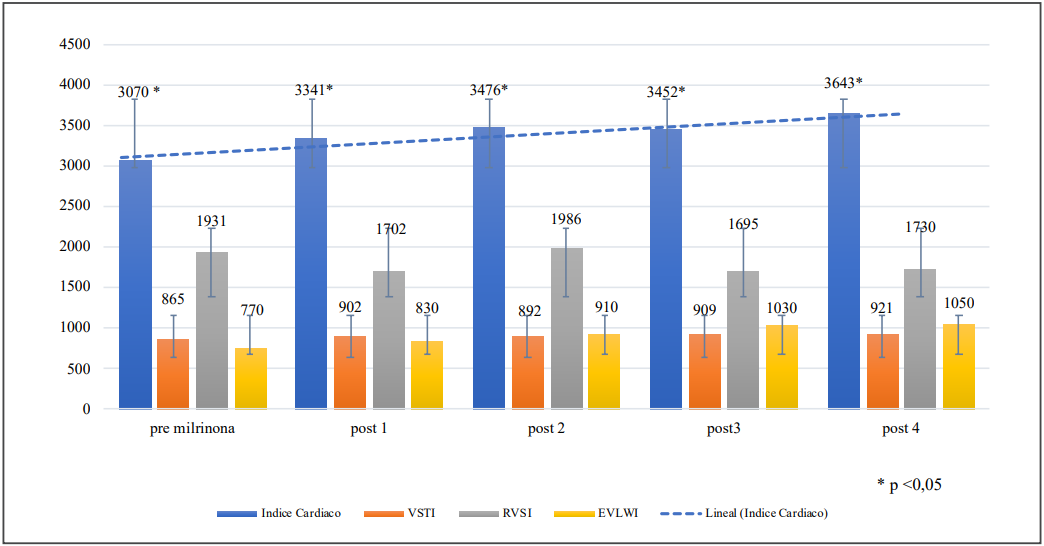
Figura 2: Evolución de los parámetros HMD y EVLWI.
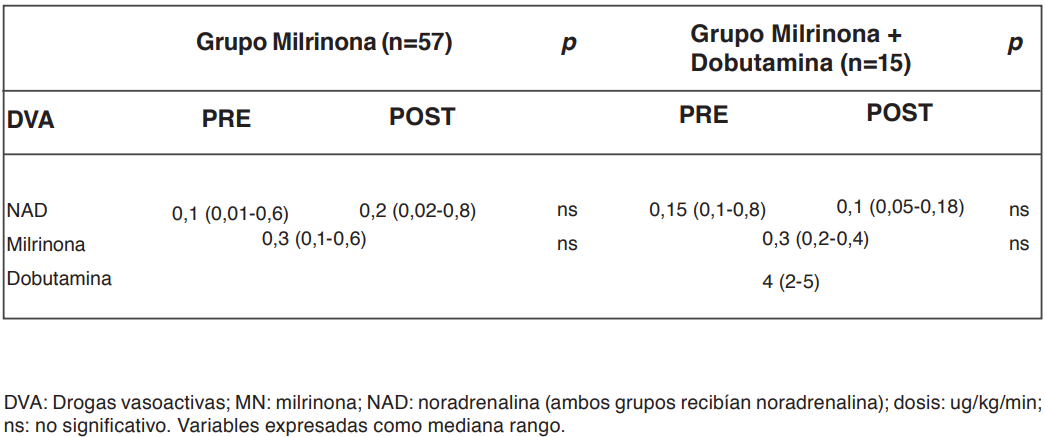
Tabla 4. DVA antes y después de incluir milrinona sin y con dobutamina agregada.
Discusión
El principal hallazgo de nuestro estudio fue que la inclusión de agentes inotrópicos mejora el IC, los parámetros metabólicos (SvcO2, DCO2 V-A, láctico arterial) y la diuresis durante las primeras 24 horas de iniciada la infusión de milrinona en pacientes con SS (Tablas 1, 2 y 3). En aquellos pacientes que se encontraban recibiendo simultáneamente Milrinona y DBT (n=15), se observó que la asociación de inotrópicos adicionó efectos benficos como incremento del GC y reducción del lactato su asociación adicionó efectos benéficos como incremento del GC y reducción del lactato (Tablas 2 y 3).
El aumento del IC podría ser atribuido a la mejoría del inotropismo ocasionado por las drogas inotrópicas, ya que el ITBV (precarga volumétrica) no sufrió modificaciones significativas durante el periodo analizado (Figura 2). La mejoría del DCO2 V-A y de la SvcO2 se observó tanto en el grupo total (n=72) como en el grupo que utilizó NAD más milrinona (n=57) (Tablas 1, 2 y 3). Todo lo anterior ocurrió en ausencia de hipotensión, sin cambios significativos en la RVSI, y sin necesidad de retirar la infusión de MN. A pesar del aumento de la diuresis (Tabla 1) el EVLW no se modificó, probablemente por el breve periodo en que se monitorizó esta variable (Figura 2).
Liet J-M et al., estudiaron aleatoriamente conejos con shock séptico inducido por inyección de pseudomonas. Un grupo recibió MN y el otro placebo. Se midió PAM e IC cada 30 minutos (PiCCO) demostrándose una caída progresiva del IC en el grupo sin MN. No se observó caída de la PAM en el grupo tratado22.
Existen dudas respecto al efecto aditivo de MN y DBT. Sakai et al., en ratas con sepsis por punción y ligadura del ciego (SPLC) y un grupo control, demostraron que los niveles de AMPc fueron significativamente elevados en ambos grupos en respuesta a MN, pero con DBT solo ocurrió en el grupo control (operado sin punción cecal). Este fenómeno se atribuye a que el efecto de DBT se encuentra afectado en las ratas SPLC como resultado de hidrólisis del fosfato del AMPc producto de up regulation de la fosfodiesterasa IV (PDE-IV), sin observar cambios en la actividad de los receptores ß123.
Wang et. al, estudiaron tres grupos de pacientes con SS: cuidado estándar, milrinona y grupo esmolol-milrinona. Los beneficios observados con la asociación de esmolol-MN se atribuyen a la reducción de la frecuencia cardiaca y de la liberación de catecolaminas inducida por esmolol, lo que optimiza el volumen de fin de diástole del VI. Sorprendentemente el grupo MN más esmolol podría mejorar la sobrevida a 28 días24. Schmittinger y cols. analizaron 40 pacientes con SS y DM sin cardiopatía previa donde usaron MN más Metoprolol enteral y concluyeron que esta combinación es viable en estos pacientes25.
En el SS, la regulación del tono vasomotor obedece a la síntesis de moléculas vasoconstrictoras y vasodilatadoras. El vasodilatador principal es ON cuya producción se encuentra aumentada por la mayor expresión de óxido nítrico sintasa inducible (i-NOS)26. En este escenario de vasodilatación se hace difícil introducir agentes inodilatadores que disminuyen el tono vasomotor como DBT (efecto b2) y MN27. Aunque MN causa más hipotensión y reducción de la RVS que DBT, nuestros resultados sugieren que MN, como inotrópico aislado, podría beneficiar a los pacientes con SS que se encuentran euvolémicos y apoyados por NAD.
Alrededor del 38% de los pacientes que cursan con un SS desarrollan DM séptica precoz (hipokinesia primaria) y 21% la desarrolla en las siguientes 24 a 48 horas, probablemente por el aumento de la poscarga inducida por NAD (hipokinesia secundaria). En consecuencia, el uso de agentes inotrópicos, al mejorar la contractilidad, pueden mantener o aumentar la presión arterial sistémica4.
Dobutamina y MN pueden desencadenar arritmias por sobrecarga de calcio intracelular e isquemia miocárdica secundaria a desequilibrio entre la entrega y consumo de oxígeno. Su uso también se asocia con incremento de la mortalidad, enfatizando la importancia de limitar su uso, especialmente si se administran en forma combinada28. A pesar de estas desventajas, muchos pacientes no pueden restablecer sus funciones orgánicas sin soporte inotrópico22,29,30,31. De los pacientes que usaron NAD y MN, 17,2% desarrollaron fibrilación auricular (FA), mientras que en el grupo que utilizó DBT+MN+NAD un 26,6% desarrolló FA.
Si comparamos DBT con MN, la primera produce mayor estimulación de la contractilidad miocárdica, mientras que MN produce mayor vasodilatación y reducción de las presiones de llenado ventricular31,32. Además, MN reduce la resistencia vascular pulmonar de manera más consistente que DBT, mostrando ventajas en disfunción ventricular derecha, como en casos de SS de foco pulmonar que cursan con RVP elevada por vasoconstricción pulmonar hipóxica. En nuestro grupo 32% de los pacientes ingresaron por SS de foco pulmonar, pero el sistema PiCCO no proporciona las variables de la arteria pulmonar21.
La asociación de MN al tratamiento convencional con DBT, dopamina y/o nitroprusiato ha demostrado poseer efectos aditivos, mejorando los parámetros de eyección ventricular. Colucci et. al, utilizando infusión intracoronaria de MN para obviar los efectos periféricos del fármaco, demostraron una mejoría de la contractilidad en pacientes que estaban recibiendo dobutamina, a través del incremento significativo del dP/dt (coeficiente entre delta presión y delta tiempo de la curva arterial) con la combinación de ambos fármacos33. Meissner, estudió los efectos hemodinámicos de DBT y MN administrados en forma aislada y combinada, observando que la administración combinada produjo mayor incremento del volumen sistólico34. En nuestro estudio ambos grupos incrementaron el IC luego de la inclusión de agentes inotrópicos (Tabla 2).
Poelaert et. al, con ecocardiograma en 25 pacientes con SS identificó 3 subgrupos: con función sistólica conservada, con disfunción diastólica y con falla global35. Levosimendan favorece la velocidad de relajación diastólica (efecto lusitrópico positivo) y MN al reducir la degradación del AMPc también beneficia el llenado ventricular, efecto que no se observa con los b adrenérgicos36,37. No obstante, lo anterior levosimendán no es superior a dobutamina como droga inotrópica en el SS38,39,40. Una limitación de nuestro estudio es que pocos pacientes fueron evaluados con ecocardiograma.
Con respecto a la mayor sensibilidad que podría tener la diferencia DCO2 frente a SvcO2 para detectar hipoperfusión, esta ventaja no se observó en nuestros pacientes. La reducción del láctico arterial es un buen indicador de mejoría de la perfusión tisular, variable que no mejoró en el grupo NAD+MN, pero este resultado tiene que ser tomado con precaución ya que nuestro estudio es descriptivo y por lo tanto no está diseñado con este fin41.
Una limitación de MN es que se acumula en los pacientes con insuficiencia renal42. En nuestro estudio 13 pacientes requirieron reemplazo renal, de los cuales 10 (76,9%) eran del grupo que se encontraba recibiendo NAD+MN, lo que podría afectar los resultados de este grupo, a pesar de que las dosis de MN fueron equivalentes en ambos grupos.
Conclusión
Un porcentaje importante de los pacientes que presentan SS cursan con depresión mio- cárdica séptica caracterizado por una FEVI <50% obtenida con ecocardiografía. Estos pacientes requieren la inclusión de agentes inotrópicos como DBT y/o milrinona y cuando existe hipotensión refractaria, epinefrina43. En nuestro estudio se observó que MN es una alternativa segura como coadyuvante para tratar el SS con DM en pacientes que se encuentran adecuadamente reanimados (ITBVI >850).
Referencias
- Parker MM, Shelhamer JH, Bacharach SL, green MV, natanson CH, Fredericket TM, et al. Profound but reversible myocardial depression in patients with septic shock. Ann Intern Med 1984; 100(4): 483-440.
- Maeder M, Fehr T, Rickli H, Ammann P. Sepsis- associated myocardial dysfunction: Diagnostic and prognostic impact of Cardiac Troponins and Natriuretic Peptides. Chest 2006; 129(5): 1349-1366.
- Vieillard-Baron A, Prin S, Chergui K, Dubourg O, Jardin F. Hemodynamic Instability in Sepsis. Bedside Assessment by Doppler Echocardiography. Am J Respir Crit Care Med 2003; 168(11): 1270-1276.
- Antonucci E, Fiaccadori E, Donadello K, Taccone FS, Franchi F, Scolletta S. Myocardial depression in sepsis: from pathogenesis to clinical manifestations and treatment. J Crit Care 2014; 29: 500-511.
- Vieillard-Baron A, Caille V, Charron C, Belliard G, Page B. Actual incidence of global left ventricular hypokinesia in adult septic shock. Crit Care Med 2008; 36: 1701-1706.
- Cunnion RE, Parrillo JE. Myocardial dysfunction in sepsis. Crit Care Clin. 1989; 5(1): 99-118.
- Jardin F, Fourme T, Page B, Loubières Y, Vieillard- Baron A, Beauchet A, et al. Persistent preload defect in severe sepsis despite fluid loading: A longitudinal echocardiographic study in patients with septic shoc Chest 1999; 116(5): 1354-1359.
- Parrillo JE. Pathogenetic mechanisms of septic shock. N Engl J Med 1993; 328(20): 1471-1477.
- Maass DL, White J, Horton JW. IL-1beta and IL-6 act synergistically with TNF-alpha to alter cardiac contractile function after burn trauma. Shock 2002; 18(4): 360-366.
- Walley KR. New Approaches to Modifying Inotropy in Sepsis-Induced Myocardial Dysfunction. Critical Care Medicine. 2017; 45(4): 754-756.
- Price S, Anning PB, Mitchell JA and Evans TW. Myocardial dysfunction in sepsis: mechanisms and therapeutic implications. European Heart Journal 1999; 20: 715-724.
- Steendijk P. The role of nitric oxide signaling in sepsis- induced myocardial dysfunctio Crit Care Med 2006; 34(1): 255-257.
- Cunnion RE, Schaer GL, Parker MM, Natanson C, Parrillo J The coronary circulation in human septic shock. Circulation 1986; 73(4): 637-644.
- Dellinger RP, Levy MM, Carlet JM, Bion J, Parker MM, Jaeschke R, et al. Surviving Sepsis Campaign: international guidelines for management of severe sepsis and septic shock. Crit Care Med 2008; 36(1): 296-327.
- Böhm M, Kirchmayr R, Gierschik P, Erdmann E. Increase of myocardial inhibitory G-proteins in catecholamine- refractory septic shock or in septic multiorgan failure. Am J Med 1995; 98: 183-186.
- Jindal N, Hollenberg SM, Dellinger RP. Pharmacologic issues in the management of septic shock. Crit Care Clin 2000; 16: 233-249.
- Krishnagopalan S, Kumar A, Parrillo JE, Kumar A. Myocardial dysfunction in the patient with sepsis. Current opinion in critical care 2002; 8(5): 376-388.
- Rhodes A, Laura E, Evans LE, Alhazzani W, Levy MM, Antonelli M, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Crit Care Med 2017; 3: 1-67.
- Lindgren S, Almqvist P, Arvidsson D, Montgomery A, Andersson KE, Haglund U. Lack of beneficial effects of milrinone in severe septic shock Circ Shock. 1990; 31(4): 365-375.
- Wilkman E, Kaukonen KM, Pettila V, Kuitunen A, Varpula M. Association between inotrope treatment and 90-day mortality in patients with septic shock. Acta Anaesthesiol Scan 2013; 57(4): 431-442.
- Tomicic V, Graf J, Echevarría G, Espinoza M, Abarca J, Montes JM, et al. Intrathoracic blood volume versus pulmonary artery occlusion pressure as estimators of cardiac preload in critically ill patients. Rev Méd Chile 2005; 133: 625-631.
- 2 Liet J-M, Jacqueline C, Orsonneau JL, Gras-LeGuen Ch, Potel G, Rozé J-Ch. The effects of milrinone on hemodynamics in an experimental septic shock model. Pediatr Crit Care Med 2005; 6: 195-199.
- Sakai M, Suzuki T, Tomita K, Yamashita S, Palikhe S, Hattori K, et al. Diminished Responsiveness to Dobutamine as an Inotrope in Mice with Cecal Ligation and Puncture Induced Sepsis: Attribution to Phosphodiesterase 4 Upregulation. Am J Physiol Heart Circ Physiol. 2017; 312(6): H1224-H1237.
- Wang Z, Wu Q, Nie X, Guo J, Yang Combination Therapy with Milrinone and Esmolol for Heart Pro- tection in Patients with Severe Sepsis: A Prospective Randomized Trial. Clin Drug Investig 2015; 35(11): 707-716.
- Schmittinger CA, Dünser MW, Haller M, Ulmer H, Luckner G, Torgersen C, et a Combined milrinone and enteral metoprolol therapy in patients with septic myocardial depression. Critical Care 2008, 12: R99.
- Tomicic V, Gerrero Endotelio y Sepsis. Med Intensiva. 2005; 29(3): 142-150.
- Jentzer JC, Coons JC, Link CB, Schmidhofer M. Pharmacotherapy Update on the Use of Vasopressors and Inotropes in the Intensive Care Unit. Journal of Cardiovascular Pharmacology and Therapeutics 2015; 20(3): 249-260.
- Ossinen J, Harjola VP, Siirila-Waris K, Lassus J, MelinJ, Peuhkurinen K, et al. The use of more than one inotrope in acute heart failure is associated with increased mortality: a multi-centre observational study. Acute Cardiac Care 2008; 10(4): 209-213.
- Amado J, Gago P, Santos W, Mimoso J, de Jesus I. Cardiogenic shock: Inotropes and vasopressors. Revista Portuguesa de Cardiologia (English Edition). 2016; 35(12): 681-695.
- Colucci WS, Wright RF, Jaski BE, Fifer MA, Wright
Braunwald E. Milrinone and dobutamine in severe heart failure: Differing hemodynamic effects and individual patient responsiveness. Circulation 1986;73(s3): III175-III183.
- Tacon CL, McCaffrey J, Delaney A. Dobutamine for patients with severe heart failure: A systematic review and meta-analysis of randomized controlled trials. Int Care Med. 2012; 38(3): 359-367.
- Romson JL, Leung JM, Bellows WH, Bronstein M, Keith F, Moores W, et al. Effects of dobutamine on hemodynamics and left ventricular performance after cardiopulmonary bypass in cardiac surgical patients. Anesthesiology 1999; 91(5): 1318-1328.
- Colucci WS, Denniss AR, Leatherman GF, Quigg RJ, Gauthier DF. Intracoronary infusion of dobutamine to patients with and without severe congestive heart failure. Dose-response relationships, correlation with circulating catecholamines, and effect of phos- phodiesterase inhibition. J Clin Invest. 1988; 81(4):1103-1110.
- Meissner A, Herrmann G, Gerdesmeyer L, Simon R. Additive effects of milrinone and dobutamine in severe heart failure. Z Kardiol. 1992; 81(5): 266-271.
- Poelaert J, Declerck C, Vogelaers D, Colardyn F, Visser CA. Left ventricular systolic and diastolic function in septic shock. Intensive Care Med 1997;23(5): 553-560.
- Barraud D, Faivre V, Damy T, Welschbillig S, Gayat E, Heymes C et a Levosimendan restores both systolic and diastolic cardiac performance in lipopolysaccharide- treated rabbits: Comparison with dobutamine and milrinone. Crit Care Med 2007; 35: 1376-1382.
- Geraci SA. Pharmacologic approach in patients with heart failure. In: Chernow B (ed). The Pharmacologic Approach to the Critically ill Patient. Williams and Wilkins, 1994; page 80-94.
- Chang W, Xie JF, Xu JY, Yang Y. Effect of levosimendan on mortality in severe sepsis and septic shock: a meta-analysis of randomised trials. BMJ Open 2018; 8(3): e019338. doi: 10.1136/bmjopen-2017-019338.
- Feng F, Chen Y, Li M, Yuan JJ, Chang XN, Dong CM. Levosimendan does not reduce the mortality of critically ill adult patients with sepsis and septic shock: A meta- analysis. Chin Med J (Engl). 2019 May 20; 132(10): 1212-1217. doi: 10.1097/CM9.0000000000000197.
- Meng JB, Hu MH, Lai ZZ, JI CL, Xu XJ, Zhang G, Tian S. Levosimendan Versus Dobutamine in Myocardial Injury Patients with Septic Shock: A Randomized Controlled Trial. Med Sci Monit. 2016 May 3; 22: 1486-1496.
- Vallée F, Vallet B, Mathe O, Parraguette J, Mari A, Silva S, et al. Central venous-to-arterial carbon dio- xide difference: an additional target for goal-directed therapy in septic shock? Intensive Care Med 2008; 34: 2218-2225.
- Woolfrey SG, Hegbrant J, Thysell H, Fox PA, Lendrem DW, Lockwood GF et al. Dose regimen adjustment for milrinone in congestive heart failure patients with moderate and severe renal failure. J Pharm Pharmacol 1995; 47: 651-655.
- Deep A, Goonasekera CD, Wang Y, Brierley J. Evolution of haemodynamics and outcome of fluid-refractory septic shock in children. Intensive Care Med. 2013; 39: 1602-1609.
¿CÃMO CITAR?
- APA
- Chicago
- Harvard
